Loading AI tools
composé chimique De Wikipédia, l'encyclopédie libre
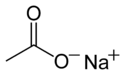
L'acétate de sodium est un composé de formule CH3COO− Na+. Il est soluble dans l'eau et constitue une bonne source d'ions acétate. Sa solution aqueuse est basique en raison de la réaction :
| Acétate de sodium | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Éthanoate de sodium | |
| Synonymes |
Acétate de soude |
|
| No CAS | (anhydre) (trihydrate) |
|
| No ECHA | 100.004.386 | |
| No CE | 204-823-8 | |
| Code ATC | B05 | |
| PubChem | 517045 | |
| No E | E262(i) | |
| FEMA | 3024 | |
| SMILES | ||
| InChI | ||
| Apparence | poudre cristalline blanche, hygroscopique[1]. | |
| Propriétés chimiques | ||
| Formule | C2H3NaO2 [Isomères] |
|
| Masse molaire[2] | 82,033 8 ± 0,002 4 g/mol C 29,28 %, H 3,69 %, Na 28,02 %, O 39,01 %, 136,08 g/mol (trihydrate) |
|
| pKa | 4,75 (pKb = 9.25) | |
| Propriétés physiques | ||
| T° fusion | 324 °C[3] (anhydre) 58 °C (trihydrate) |
|
| T° ébullition | sans objet (anhydre)[4] 122 °C (trihydrate) |
|
| Solubilité | 365 g·l-1 (eau, 20 °C))[5] | |
| Masse volumique | 1,52 g·cm-3 (anhydre, 20 °C)[5], 1,42 g·cm-3 (trihydrate, 20 °C)[5] |
|
| T° d'auto-inflammation | 607 °C[5] | |
| Point d’éclair | > 250 °C (anhydre, coupelle fermée)[5] | |
| Précautions | ||
| SIMDUT[6],[7] | ||
| Acétate de sodium : Produit non contrôlé Acétate de sodium trihydraté : Produit non contrôlé |
||
| Directive 67/548/EEC | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
CH3COO− Na+ + H2O CH3COOH + HO− Na+.
Ce composé est utilisé pour faire des expériences simples de solutions aqueuses sursaturées.

L'acétate de sodium est une base conjuguée de l'acide acétique. En conséquence, il est extrêmement simple de le synthétiser en mélangeant cet acide (habituellement en solution à 5–8% sous forme de vinaigre) avec du bicarbonate de sodium, du carbonate de sodium ou de la soude caustique (hydroxyde de sodium). Les autres produits de ces réactions sont de l'eau (et du dioxyde de carbone dans les deux premiers cas).
Les réactions qui entrent en jeu sont les suivantes :
Bicarbonate de sodium :
Carbonate de sodium :
Soude caustique : CH3COOH + NaOH → CH3COONa + H2O
L'acétate de sodium apparaît également comme sous-produit de la saponification des acétates d'alkyle par la soude.
L'acétate de sodium peut être utilisé pour synthétiser des esters suivant la réaction de substitution :
CH3COONa + RBr → CH3COOR + NaBr
L'acétate de sodium peut également former du méthane (CH4) par décarboxylation sous certaines conditions (pyrolyse en présence d'hydroxyde de sodium) :
L'acétate de sodium est un irritant, il est préférable d'éviter le contact du produit pur avec la peau.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.