Remove ads
Le dioxyde de sélénium est un composé chimique de formule SeO2. Il s'agit d'un solide incolore se présentant sous la forme d'aiguilles blanchâtres translucides[3]. On peut l'obtenir par oxydation du sélénium aussi bien par combustion dans l'oxygène O2 de l'air que sous l'action de l'acide nitrique HNO3[3] ou du peroxyde d'hydrogène H2O2, la voie la plus efficace étant peut-être la déshydratation de l'acide sélénieux H2SeO3 :
| Dioxyde de sélénium | |
 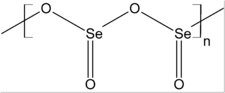  Apparence et structure du dioxyde de sélénium |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.028.358 |
| No CE | 231-194-7 |
| No RTECS | VS8575000 |
| PubChem | 24007 |
| SMILES | |
| InChI | |
| Apparence | aiguilles blanches translucides solubles dans l'eau |
| Propriétés chimiques | |
| Formule | SeO2 |
| Masse molaire[1] | 110,96 ± 0,03 g/mol O 28,84 %, Se 71,16 %, |
| Propriétés physiques | |
| T° fusion | 315 °C[2] (sublimation) |
| Solubilité | 384 g·L-1 à 20 °C[2] |
| Précautions | |
| SGH[2] | |
| H373, H410, P273, P314, P304+P340 et P309+P310 |
|
| Transport[2] | |
| Écotoxicologie | |
| DL50 | 68,1 mg·kg-1 (souris, oral)[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Remove ads
Le dioxyde de sélénium solide est un polymère unidimensionnel constitué d'une chaîne où alternent des atomes d'oxygène et de sélénium. Les atomes de sélénium ont une géométrie pyramidale. Les liaisons Se–O ont une longueur de 162 pm. L'orientation des atomes d'oxygène est alternée le long de la chaîne d'atomes de sélénium et d'oxygène, ce qui correspond, du point de vue stéréochimique, à un arrangement syndiotactique.
En phase gazeuse, le dioxyde de sélénium forme des dimères et des oligomères, et devient monomérique à haute température. Le monomère présente une géométrie très semblable à celle du dioxyde de soufre SO2, avec des liaisons de 161 pm. Le dimère a été observé dans une matrice d'argon cryogénique, la spectroscopie infrarouge indiquant une géométrie centrosymétrique en chaise. La dissolution de l'oxydichlorure de sélénium (en) SeOCl2 donne le trimère [Se(O)O]3.
La molécule de SeO2 monomérique est polaire, avec un moment dipolaire de 2,62 D du milieu des deux atomes d'oxygène vers l'atome de sélénium[3].
Le dioxyde de sélénium solide se sublime facilement. À très faible concentration, la vapeur a une odeur repoussante rappelant celle du raifort en décomposition, et peut provoquer des sensations de brûlure, dans les muqueuses, à forte concentration ; ce composé est toxique, comme tous les composés du sélénium.
Le dioxyde de sélénium est un oxyde acide : il se dissout dans l'eau en donnant de l'acide sélénieux H2SeO3. Il réagit avec des bases en formant des sélénites, contenant l'anion SeO3−. Ainsi, la réaction avec l'hydroxyde de sodium NaOH donne du sélénite de sodium Na2SeO3 :
Remove ads
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
Remove ads





