Loading AI tools
composé chimique De Wikipédia, l'encyclopédie libre
Le dioxyde de chlore (ou bioxyde de chlore) est un gaz jaune rougeâtre, de formule ClO2, qui est l'un des divers oxydes connus du chlore. Le dioxyde de chlore est relativement stable dans ses états gazeux et liquide, mais prompt à exploser. En pratique, on ne l'utilise jamais à l'état pur.
| Dioxyde de chlore | ||
| ||
 | ||
| Dioxyde de chlore à sa pression de vapeur saturante : Le haut du tube contient la phase gazeuse tandis que le bas est sous forme liquide. Le changement d'état s'effectue à 11°C à pression atmosphérique. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Dioxyde de chlore | |
| Synonymes |
Oxyde de chlore |
|
| No CAS | ||
| No ECHA | 100.030.135 | |
| No CE | 233-162-8 | |
| No E | E926 | |
| Apparence | gaz rouge-jaune, d'odeur acre[1]. | |
| Propriétés chimiques | ||
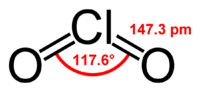
| Formule | ClO2 [Isomères] |
|
| Masse molaire[2] | 67,452 ± 0,003 g/mol Cl 52,56 %, O 47,44 %, |
|
| Propriétés physiques | ||
| T° fusion | −59 °C[1] | |
| T° ébullition | 11 °C[1] | |
| Solubilité | dans l'eau à 20 °C : 8 g·l-1[1] | |
| Masse volumique | 1,642 à 0 °C (liquide)[3] 1,77 à −55 °C |
|
| Limites d’explosivité dans l’air | en volume % dans l'air : >10[1] | |
| Pression de vapeur saturante | à 20 °C : 101 kPa[1] | |
| Thermochimie | ||
| ΔvapH° | 30 kJ·mol-1 (1 atm, 11 °C)[4] | |
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 10,33 ± 0,02 eV (gaz)[5] | |
| Précautions | ||
| SGH[6],[7] | ||
| H270, H314, H330, H400 et EUH006 H301, H314 et H400 |
||
| SIMDUT[8] | ||
    C, D1A, E, F, |
||
| Inhalation | Très toxique | |
| Peau | provoque des brûlures | |
| Yeux | provoque des brûlures | |
| Ingestion | Très toxique | |
| Écotoxicologie | ||
| DL50 | 292 mg·kg-1 (rat, oral)[9] | |
| Seuil de l’odorat | bas : 0,1 ppm haut : 15 ppm[10] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Le dioxyde de chlore peut être produit avec du chlorate de sodium en solution aqueuse concentrée (à saturation) chaude (60 °C) par un réducteur par exemple du peroxyde d'hydrogène, du dioxyde de soufre (risque d'explosion par élévation de la température dans la zone de réaction) ou l'acide chlorhydrique :
ainsi
Cette réaction a le défaut de produire du chlore, on peut la combiner avec la réaction suivante:
Mais comme le chlorite de sodium NaClO2 est plus coûteux à produire que le chlorate de sodium NaClO3, la réaction suivante est préférée :
Afin d'éviter la manipulation du chlorure d'hydrogène HCl, volatil et corrosif, une autre réaction utilise l'acide sulfurique H2SO4 moins cher et peu volatil :
ou encore avec un réducteur plus puissant, le sulfite de sodium Na2SO3 qui donne du dioxyde de soufre SO2 comme intermédiaire :
puis
au total :
Pour diluer le dioxyde de chlore, un réducteur encore plus puissant peut être utilisé, l'oxalate de sodium, Na2C2O4 :
Le dioxyde de carbone CO2 produit dilue le dioxyde de chlore ce qui diminue le risque d'explosion.
Le dioxyde de chlore peut être produit par action de chlorite de sodium et de chlore gazeux :
Il est explosif si sa concentration dans l’air dépasse 10 %. Il ne peut donc pas être stocké et acheminé dans une station, il doit donc être préparé in situ.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.