Détection du quorum
mécanisme de synchronisation de l'expression génétique dans une population bactérienne De Wikipédia, l'encyclopédie libre
La détection du quorum, ou quorum sensing, est la capacité d'un micro-organisme (bactérie, archée, microchampignon, virus) à détecter et à réagir à la densité de population de ce microbe par des mécanismes de régulation génétique.
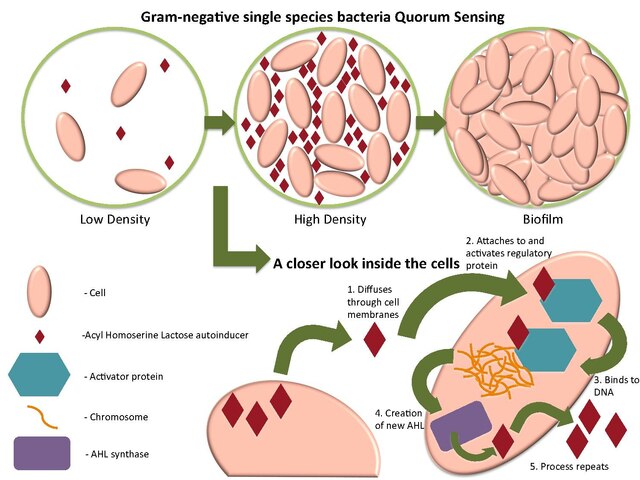
À haute densité de population, la concentration de signaux moléculaires présents dans l'environnement sont perçus par les micro-organismes. Ces signaux sont enregistrés grâce à des récepteurs protéiques intracellulaires qui reconnaissent les séquences d'ADN spécifiques des gènes et régulent leur expression. Ce processus permet aux microbes de coordonner leur comportement collectif.
Histoire de la découverte de la détection du quorum
La détection du quorum a été observée pour la première fois chez Vibrio fischeri[1], renommé depuis Photobacterium fischeri puis Aliivibrio fischeri, une bactérie bioluminescente et symbiotique, vivant dans l'organe lumineux de certains céphalopodes comme la sépiole. Quand les vibrions sont sous forme planctonique (à l'état libre), la concentration du signal moléculaire que les bactéries produisent, appelé auto-inducteurs, est faible, et les cellules ne sont pas luminescentes. Au contraire, dans l'organe lumineux de la sépiole, où les vibrions sont très nombreux (environ 1011 cellules par mL), les auto-inducteurs présents à haute concentration sont perçus par la population bactérienne, stimulant ainsi la transcription d'un gène associé à la synthèse de luciférase, un enzyme capable de produire de la lumière à partir d'ATP.
Principes généraux
Résumé
Contexte
La détection du quorum correspond au mécanisme de synchronisation de l'expression (ou de la répression) de gènes particuliers au sein d'une population bactérienne en fonction de la densité de cette population. Elle implique la capacité des bactéries à communiquer avec leurs congénères via des signaux moléculaires et, éventuellement, pour certaines espèces (archées), à disposer d'une horloge biologique endogène (Rythme circadien bactérien)[réf. nécessaire].
Mécanisme général de la détection du quorum
Les bactéries qui utilisent la détection du quorum produisent des signaux moléculaires dits « auto-inducteurs ».
- Lorsque la densité de la population bactérienne est faible, la diffusion réduit rapidement la concentration de l’auto-inducteur dans l'environnement.
- Au contraire, avec la multiplication cellulaire dans un espace confiné, la densité de la population augmente, et la concentration de l'auto-inducteur dépasse un seuil critique qui est alors perçu par les bactéries qui le produisent : on dit alors que le quorum est atteint.
- Cette perception active alors souvent la surproduction du signal auto-inducteur, conduisant ainsi à une boucle de rétroaction positive permettant de synchroniser sa perception au sein de la population microbienne.
La présence des auto-inducteurs est perçue par des récepteurs protéiques intracellulaires.
Ces récepteurs fixent l'auto-inducteur (dont la concentration intracellulaire reflète la concentration extracellulaire).
Le récepteur ainsi activé reconnait certaines séquences d'ADN, spécifiques des gènes régulés par détection du quorum et active ou réprime leur expression.
Sans que l'on puisse véritablement parler de superorganisme, la population peut alors localement réagir un peu comme une colonie cohérente, plus que comme une simple somme d'individus.
Les auto-inducteurs fonctionnent un peu comme des hormones ; ils sont perçus par les bactéries à des concentrations très faibles (de l'ordre de 1 pmol à 1 µmol).
Parmi les signaux connus, on peut citer les N-acyl homosérine lactones (NAHL), les butyrolactones, des peptides cycliques tels ComX, ou l'autoinducteur 2 (AI-2), un des seuls composés biologiques connus contenant du bore.
Les différents types de détection du quorum
Il existe de nombreuses molécules de communication cellulaire appartenant au système de la détection du quorum. Les molécules utilisées dépendent de l’espèce bactérienne considérée, mais il est possible de classer ces systèmes de communication en trois grandes catégories.
Détection du quorum de type 1
Le système de quorum de type 1 utilise les N-acyle homosérine lactones (aussi appelées autoinducer 1), molécules portant un cycle lactone et une chaine acyle de longueur variable, comme molécules-signaux. Il s'agit du système le plus couramment cité. Il est utilisé chez des espèces comme Vibrio fischeri, Pseudomonas aeruginosa, Yersinia enterocolitica, Agrobacterium tumefaciens ou Pectobacterium carotovorum.
Synthèse des N-acyle homosérine lactones (NAHLs) : les enzymes permettant la synthèse des NAHL chez Photobacterium se regroupent dans le clade des LuxI. Les substrats de Lux I sont des protéines transporteuses d'acyle, molécules donneuses intracellulaires de chaînes acyle et la S-adénosyl méthionine (SAM), donneuse intracellulaires de méthyle. L'enzyme Lux I crée un pont amide entre le SAM et la chaîne acyle de la protéine transporteuse d'acyle. Puis Lux I réalise une réaction dite de « lactonisation », qui permet la création du cycle lactone. Selon le type de protéine transporteuse d'acyle impliquée dans ce processus de synthèse, différentes NAHL peuvent être formées. La longueur de la chaîne acyle est variable, ainsi que l'est son degré d'insaturation (en général les chaines acyles sont saturées) et sa substitution au niveau du carbone 3 (par un groupe hydroxy ou cétone). L'enzyme de synthèse LuxI ne synthétise qu'un seul type de NAHL, ou deux ou trois NAHL de structureS très voisineS. Ainsi, chaque organisme produit des NAHL qui lui sont spécifiques sans que cela exclue la possibilité de communication croisée. Différentes bactéries, comme par exemple Pseudomonas aeruginosa, sont cependant capables de produire deux types de NAHLs différents, la 3-oxo-C12-HSL, à longues chaînes acyles, et la C4-HSL, qui possède une chaîne acyle plus courte. Pseudomonas aeruginosa possède en effet deux enzymes de synthèse, LasI et RhlI.
Les NAHLs sont libérées dans le milieu, peuvent diffuser dans les membranes et se lier à un régulateur de réponse de type « Lux R ». Lorsque Lux R est lié à une NAHL, il est alors capable de se dimériser et d’agir en tant que régulateur transcriptionnel de nombreux gènes.
Détection du quorum de type 2
Le système de détection du quorum de type 2 utilise deux types de molécules, les autoinducer 2 (diester de furanosyl borate) et 3. Ce système implique une détection via des senseurs histidines kinases membranaire. Il est utilisé par des espèces bactériennes comme Escherichia coli, Vibrio cholerae ou Salmonella typhimurium.
Autoinducteur 2
L'autoinducteur 2 est le diester de furanosyl borate. Chez Vibrio fischeri, il est synthétisé par une enzyme dite « Lux S » à partir de S-adénosine homocystéine (SAH), composé toxique pour la cellule. Le diester de furanosyl borate est libéré dans le milieu, il est reconnu par un senseur membranaire, « Lux P », capable d'autophosphorylation. Lux P transfère son phosphate sur un intermédiaire, « Lux Q », puis sur « Lux U » et enfin sur le régulateur de réponse « Lux O », qui, lorsqu'il est phosphorylé, permet la transcription de petits ARN régulateurs. Ces ARN non codants vont inhiber le répresseur Lux R et permettre la dérépression de certains gènes.
Autoinducteur 3
Système de signalisation intercellulaire mal connu, dont la molécule n’a pas été purifiée. Les précurseurs sont peu connus. Ces molécules sont capables d'activer des senseurs histidine kinases. Une cascade d'activation intracellulaire permet la régulation de gènes. Ce système est présent chez des espèces entéropathogènes et peut être activé par la détection d'hormones de l'hôte, l'épinéphrine et la norépinéphrine.
Détection du quorum de type 3
Le système de détection du quorum de type 3 est utilisé par les eubactéries à coloration de Gram positive, et implique des peptides en tant que molécules de communication.
Autres systèmes de communication intracellulaire
Il existe de nombreuses autres molécules permettant une communication intercellulaire. Chez les bactéries à coloration de Gram négative, on trouve le "PQS" (Pseudomonas Quinolone Signal), présent chez les bactéries du genre Pseudomonas, le "DSF" (difusible factor) présent chez le phytopatogène Xyllela, ou l'ester méthylique du 3-hydroxy palmitate (3OH, PAME en anglais) chez un autre phytopathogène, Ralstonia solanacearum.
Rôles de la détection du quorum et des fonctions qu'il régule
La détection du quorum joue un rôle majeur dans les comportements coloniaux de populations microbiennes, en permettant des comportements coordonnés, ou certaines actions entre bactéries de la même espèce en fonction de la densité de leur population.
Les fonctions régulées par détection du quorum sont très diverses chez les bactéries. Elles incluent notamment :
- la virulence, le pouvoir pathogène (ex : chez Pectobacterium carotovorum, ou les bactéries opportuniste Pseudomonas aeruginosa[2]) ;
- la formation d'un biofilm ;
- l'acquisition collective de nutriments ;
- le transfert conjugatif de plasmides (ex : chez Agrobacterium ou chez différents rhizobiums) ;
- la production d'antibiotiques ou d'antifongiques (ex : chez Chromobacterium violaceum ; Pseudomonas aureofaciens et P. fluorescens) ;
- l'apparition de la compétence, c'est-à-dire la capacité d'une cellule à absorber une molécule d'ADN libre dans son environnement (ex : chez Bacillus) ;
- la mise en place de flagelles (ex : chez Burkholderia).
Recherche et prospective
Résumé
Contexte
L'étude de la détection du quorum relève de l'écologie microbienne et de la biologie des populations. Sur la base d'une meilleure connaissance de ces phénomènes, des chercheurs espèrent notamment pouvoir :
- produire des biocapteurs qui, par exemple, deviendraient luminescents au-delà d'un certain seuil ;
- contrer l'antibiorésistance, en développant des stratégies médicales alternatives ne cherchant plus à éliminer totalement les bactéries, mais à empêcher leur collaboration. Deux méthodes sont possibles ou complémentaires :
- brouiller leurs communications, par exemple en introduisant des micro-organismes capables de dégrader les signaux de la détection du quorum, ou en introduisant des molécules qui miment les auto-inducteurs, prenant ainsi leur place au niveau des récepteurs, sans activer ces derniers (approche dite d'inhibition de la détection du quorum);
- brouiller leur organisation, en introduisant dans une colonie pathogène des bactéries « asociales » ne jouant pas le jeu et continuant à se reproduire sans émettre de signal auto-inducteur[3]. Des biologistes avaient en effet observé dans une colonie de Pseudomonas aeruginosa que certains individus, bien qu'informés grâce au système QS de la densité présente d'autres bactéries, n'émettaient eux-mêmes pas de signal auto-inducteur ; ce faisant, ils retardaient le moment où le quorum serait atteint et, s'ils étaient assez nombreux, ils empêcheraient que ce quorum soit atteint, tout en entretenant un désordre au sein de la colonie[3]. Stuart A. West a inoculé in vivo des souris avec des Pseudomonas aeruginosa collaborant normalement grâce au système QS : les souris sont alors rapidement mortes de l'infection. Par contre, en inoculant aux souris des bactéries mutantes et « asociales » (de la même espèce mais n'émettant aucun signal QS), l'infection ne provoquait la mort que d'une partie des souris. Quand il a inoculé un mélange des deux types de bactéries, le taux de mortalité est resté proche de celui généré par les seules bactéries « asociales » [3]. Ceci laisse envisager de nouveaux modes thérapeutiques[3].
Notes et références
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

