Top Qs
Chronologie
Chat
Contexte
Épichlorohydrine
groupe de stréréoisomères De Wikipédia, l'encyclopédie libre
Remove ads
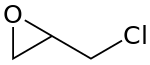
L'épichlorohydrine ou épichlorhydrine ou 1-chloro-2,3-époxypropane, est un composé organochloré de formule semi-développée CH2CHOCH2Cl, liquide volatil toxique, incolore à forte odeur d'ail. L'épichlorohydrine est chirale car un atome de carbone est stéréogène, il existe donc deux formes énantiomères de ce composé.
Remove ads
Malgré son nom, l'épichlorohydrine n'appartient pas à la famille des chlorohydrines, puisqu'elle n'est pas un alcool halogéné, mais un époxyde. Certains intermédiaires directs de sa synthèse, tels le 2,3-dichloro-1-propanol et le 1,3-dichloro-2-propanol, sont eux en revanche des chlorohydrines.
Remove ads
Production
Résumé
Contexte
L'épichlorohydrine est fabriquée à partir de chlorure d'allyle en deux étapes, d'abord, une hydrochloration utilisant l'acide hypochloreux, donnant un mélange de chlorohydrines :

La deuxième phase aboutit à la formation de l'époxyde par traitement avec une base :

Par cette voie, plus 800 000 tonnes (1997) d'épichlorohydrine sont produites annuellement[9].
Voie du glycérol
L'épichlorohydrine fut décrite pour la première fois en 1848 par Marcellin Berthelot. Le composé fut isolé durant des études sur les réactions entre le glycérol et le chlorure d'hydrogène gazeux[10].
Rappelant l'expérience de Berthelot, des usines de glycérol-épichlorhydrine (GTE, pour glycerol-to-epichlorohydrin) ont été commercialisées. Cette technologie tire parti de la disponibilité de glycérols bon marché provenant de la transformation des biocarburants[11]. Dans le procédé mis au point par Dow Chemical, le glycérol subit deux réactions de substitution lorsqu'il est traité avec du chlorure d'hydrogène en présence d'un acide carboxylique utilisé comme catalyseur. La réaction forme l'un des deux mêmes intermédiaires que dans le procédé chlorure d'allyle/acide hypochloreux, le 1,3-dichloro-2-propanol, et il est également traité avec une base pour former de l'épichlorhydrine[12].

Autres voies
D'autres voies impliquant moins d'intermédiaires chlorés continuent à être explorées. On peut citer par exemple l'époxydation du chlorure d'allyle[13].
Remove ads
Utilisation
Résumé
Contexte
Synthèse de glycérol et de résines époxyde
L'épichlorohydrine est principalement convertie en éther diglycidique du bisphénol A (en), un élément de base dans la fabrication des résines époxyde[14]. Elle est également un précurseur de monomères pour d'autres résines et polymères, notamment des résines échangeuses d'ions, des polyétherpolyols pour des mousses polyuréthane ignifugées, des alkylglycéryléthersulfonates pour des détergents, des élastomères (codes de polymère CO, ECO), et des résines spéciales pour le traitement du papier[15].
Un autre usage est la conversion en glycérol synthétique. Cependant, l'augmentation rapide de la production de biodiesel, où le glycérol est un déchet, a entraîné une surabondance de glycérol sur le marché, rendant ce procédé non rentable. Le glycérol synthétique n'est désormais utilisé que dans des applications pharmaceutiques et biotechnologiques sensibles où les normes de qualité sont très élevées[16].
Applications mineures et de niche
L'épichlorhydrine est un précurseur polyvalent dans la synthèse de nombreux composés organiques. Par exemple, elle peut être convertie en nitrate de glycidyle, un liant énergétique utilisé dans les compositions explosives et propulsives[17]. L'épichlorhydrine est mise à réagir avec un nitrate alcalin, tel que le nitrate de sodium, produisant du nitrate de glycidyle et un chlorure alcalin. Elle est utilisée comme solvant pour la cellulose, les résines et les peintures, et elle a trouvé une utilisation comme fumigant contre les insectes[18].
Les polymères fabriqués à partir d'épichlorhydrine, par exemple les résines polyamide-épichlorhydrine, sont utilisés dans le renforcement du papier et dans l'industrie alimentaire pour fabriquer des sachets de thé, des filtres à café et des boyaux synthétiques pour saucisses/saucissons, ainsi que pour la purification de l'eau[19].
Une application biochimique importante de l'épichlorhydrine est son utilisation comme agent de réticulation pour la production de résines de chromatographie d'exclusion stérique en Sephadex (en) à partir de dextrane[20].
Remove ads
Sécurité
L'épichlorhydrine est classée par plusieurs agences et groupes internationaux de recherche en santé comme un agent cancérigène probable chez l'homme[21],[22],[23]. La consommation (orale) prolongée de niveaux élevés d'épichlorhydrine pourrait entraîner des problèmes d'estomac et un risque accru de cancer[24]. L'exposition professionnelle à l'épichlorhydrine par inhalation pourrait entraîner une irritation des poumons et un risque accru de cancer du poumon[25].
L'épichlorhydrine est inflammable, formant des produits de décomposition dangereux en cas de feu. Elle est toxique par inhalation, par contact avec la peau et par ingestion, et peut provoquer des brûlures. Elle peut entraîner une sensibilisation par contact avec la peau.
Notes et références
Articles connexes
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads