Loading AI tools
étude des quantités de réactifs et de produits en jeu au cours d'une réaction chimique De Wikipédia, l'encyclopédie libre
En chimie, la stœchiométrie, du grec ancien στοιχεῖον / stoikheîon (« élément ») et μέτρον / métron (« mesure »), est un calcul qui permet d'analyser les quantités de réactifs et de produits qui sont en jeu au cours d'une réaction chimique. C'est aussi la proportion des éléments dans une formule chimique.
Jeremias Benjamin Richter (1762-1807) fut le premier à énoncer les principes de la stœchiométrie, en 1792. Il écrivait alors :
« La stœchiométrie est la science qui mesure les proportions quantitatives ou rapports de masse dans lesquels les éléments chimiques sont impliqués. »
Lors d'une réaction chimique on observe une modification des substances présentes : certaines substances sont consommées, on les appelle les « réactifs », d'autres substances sont formées, ce sont les « produits ».
À l'échelle microscopique, la réaction chimique est une modification des liaisons entre atomes, par déplacement des électrons : certaines liaisons sont rompues, d'autres sont formées, mais les atomes eux-mêmes sont conservés. C'est ce qu'on appelle la conservation de la matière qui se traduit par deux lois :
Les relations stœchiométriques entre les quantités de réactifs consommés et de produits formés découlent directement des lois de conservation. Elles sont déterminées à partir de l'équation-bilan de la réaction.
Jeremias Benjamin Richter, qui avait eu le célèbre philosophe Emmanuel Kant comme professeur lors de ses études universitaires, en avait gardé l'idée cartésienne qu'une science naturelle n'est une vraie science que si elle contient des mathématiques[1]. Il fut le premier à montrer que les corps avaient une composition chimique constante. Il a montré également que deux corps qui réagissent le font toujours dans des quantités proportionnelles.
Il a conduit ses travaux en particulier sur la réaction acido-basique de HCl avec CaCO3 ou avec MgCO3. Il a également travaillé avec la réaction de précipitation entre BaCl2 et MgSO4. Il ne connaissait pas les formules chimiques et il nommait les corps par les symboles des alchimistes.
D'autres savants ont contribué à l'élaboration de la notion de stœchiométrie, notamment Ernst Gottfried Fischer de Berlin, Claude Louis Berthollet, Jöns Jacob Berzelius et John Dalton.
Lorsqu'on écrit l'équation-bilan d'une réaction chimique, elle doit respecter les règles de conservation de la matière.
Pour respecter ces règles on est amené à placer devant la formule chimique de chaque espèce chimique un nombre, appelé nombre stœchiométrique (l'appellation « coefficient stœchiométrique » n'est pas recommandée par l'IUPAC)[2], qui indique les proportions entre les espèces engagées et entre les espèces formées. Ce sont donc des nombres sans dimension qui ne doivent pas être confondus avec une quantité de matière, n. L'équation de la réaction est en effet indépendante de la quantité de matière mais elle permet de calculer les quantités de matière après réaction si l'on connait les quantités réelles mises en jeu au départ.
Le nombre (ou facteur) stœchiométrique d'une espèce chimique dans une réaction chimique donnée est le nombre qui précède sa formule dans l'équation considérée (un, à défaut[3]). Dans l'exemple précédent :
le nombre stœchiométrique du méthane est 1, celui du dioxygène est 2, celui du dioxyde de carbone est 1 et celui de l'eau est 2.
Dans les cas simples (par exemple dans le cas de l'enseignement de la réaction chimique), le nombre stœchiométrique est un entier naturel. Cependant, des fractions, voire des nombres décimaux sont utilisables pour :
Dans l'écriture compacte des équations chimiques, pour simplifier les calculs thermodynamiques, il est d'usage d'adopter la convention .
Quand les quantités de tous les réactifs sont proportionnelles à leurs nombres stœchiométriques au début de la réaction, on dit que :
ces trois expressions ayant strictement la même signification.
Dans ces conditions, si la réaction est totale, tous les réactifs seront entièrement consommés.
Si les réactifs ne sont pas introduits initialement dans les proportions stœchiométriques, et si la réaction est totale :
Remarque : ceci est valable pour une réaction totale, sachant que certaines réactions sont limitées ou peuvent s'inverser. En fin de réaction, les réactifs ne sont pas entièrement consommés, même s'ils avaient été introduits dans les proportions stœchiométriques ! Ceci est dû au fait que les produits d'une réaction limitée peuvent eux-mêmes réagir ensemble pour redonner les réactifs de départ, ce qui n'est pas possible dans une réaction totale. Cette inversabilité conduit à un état d'équilibre chimique dans lequel coexistent les réactifs et les produits dans une proportion fixée par une constante dite « constante d'équilibre » (voir Équilibre chimique).
Quelles que soient les conditions initiales, les quantités de réactifs consommés et de produits formés sont proportionnelles aux nombres stœchiométriques de l'équation de la réaction chimique.
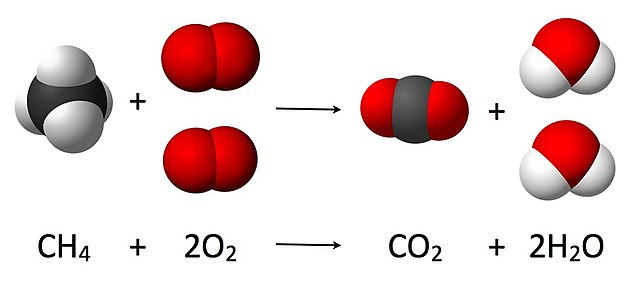
Soit l'équation-bilan de la combustion du méthane :
Puisque la combustion d'une mole de méthane (CH4, nombre stœchiométrique : 1) produit une mole de dioxyde de carbone (CO2, nombre stœchiométrique : 1), les deux substances sont consommées et formées dans les mêmes proportions.
La quantité d'eau formée (H2O, nombre stœchiométrique : 2) peut être déduite de la même façon. Puisque la combustion d'une mole de méthane produit deux moles d'eau, le nombre de moles d'eau produit sera toujours deux fois supérieur au nombre de moles de méthane consommé.
Il est possible d'utiliser les proportions avec n'importe quels réactifs ou produits de l'équation afin de calculer le nombre de moles produit ou consommé.
Cette méthode est également effective entre réactifs (où l'un des réactifs est un réactif limitant) ainsi qu'entre produits.
La stœchiométrie est également la proportion avec laquelle les éléments sont présents dans une formule brute. Par exemple pour l'éthane, C2H6, les éléments chimiques C et H sont présents avec la stœchiométrie 2 et 6 respectivement.
Dans le cas des composés ioniques, la stœchiométrie doit respecter le principe de neutralité électrique. Par exemple, le carbonate d'aluminium associe un anion portant deux charges électriques négatives et un cation portant trois charges positives. La stœchiométrie du sel est, pour cette raison Al2(CO3)3.
Dans certains composés, la stœchiométrie des éléments n'est pas entière. Le cas le plus classique est l'oxyde de fer FeO dont la formule est en fait Fe1-xO. Cette absence de stœchiométrie entière vient du fait que cet oxyde de fer possède une proportion importante de fer(III) parmi les fer(II), et qu'il faut, pour respecter l'électroneutralité de l'oxyde, moins d'ions fer que d'ions oxyde[6].
La stœchiométrie des composés a fait l'objet de débats qui durèrent toute la première moitié du XIXe siècle. Par exemple, l'eau avait pour certains la formule HO, en vertu d'un « principe » imposant que la stœchiométrie soit la plus simple possible. Pour d'autres, la formule était H2O en vertu du fait que l'électrolyse décompose l'eau en un volume de O2 pour deux volumes de H2 et que le volume des gaz est proportionnel à la quantité de molécules qu'ils contiennent, à même pression. Cette dernière loi (dite loi d'Avogadro-Ampère) n'était pas universellement acceptée à l'époque. Les conséquences furent importantes car dans un cas, les masses équivalentes (aujourd'hui masses molaires) étaient M(H) = 1 et M(O) = 17 et dans l'autre M(H) = 1 et M(O) = 16, or tout travail de chimie devait être présenté avec le système de masses équivalentes utilisé. Il en a été de même pour la stœchiométrie des molécules telles que le dichlore, Cl pour certains et Cl2 pour d'autres. La fin de la cacophonie qui résultait de cette méconnaissance de la stœchiométrie des corps les plus simples intervint à la suite du Congrès de Karlsruhe de 1860 à l'initiative de Cannizzaro.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.