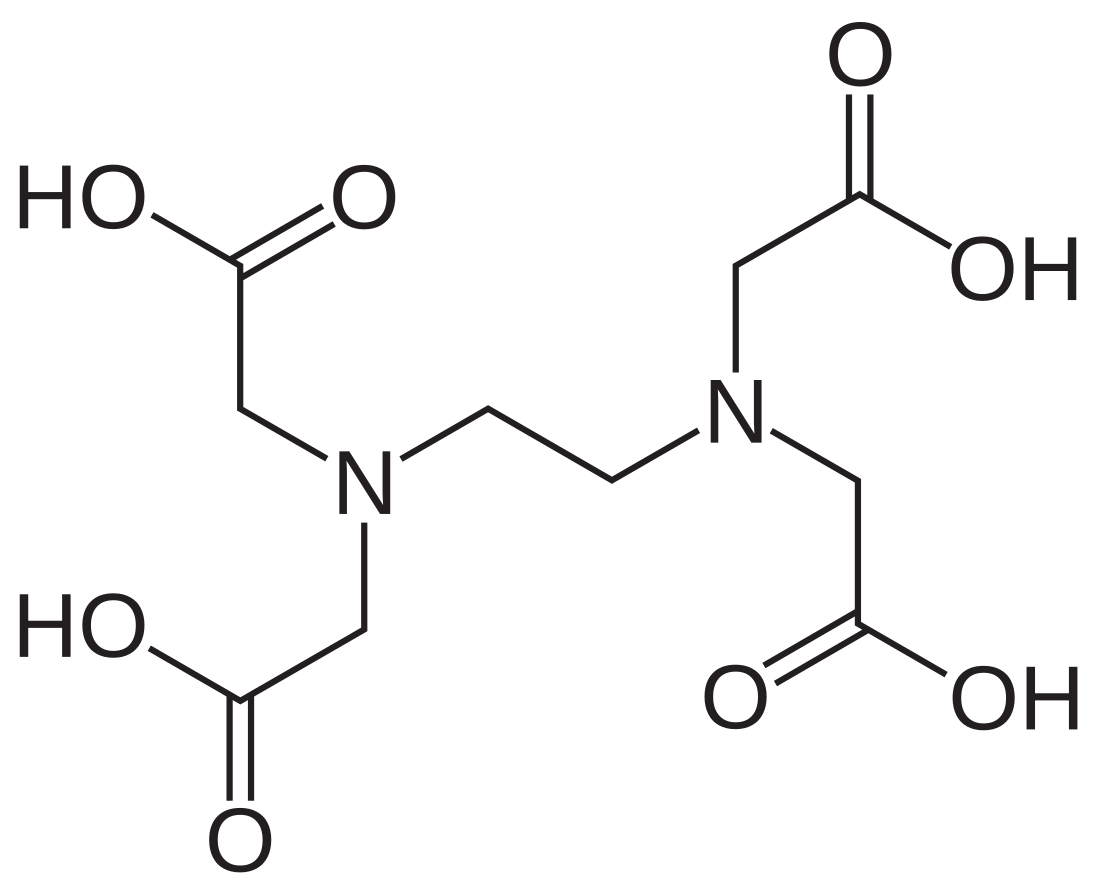
L’EDTA (éthylènediaminetétraacétique), ou acide éthylènediaminetétraacétique, est un acide diaminotétracarboxylique de formule C10H16N2O8.
| EDTA | |

| |
| Identification | |
|---|---|
| Nom UICPA | acide 2,2',2",2"'-(éthane-1,2-diyldinitrilo)tétraacétique[1] acide 2-[2-[bis(carboxyméthyl)amino]éthyl- (carboxyméthyl)amino]acétique[2] |
| Synonymes |
acide éthylène-diamine-tétraacétique |
| No CAS | |
| No ECHA | 100.000.409 |
| No CE | 200-449-4 |
| No RTECS | AH4025000 |
| Code ATC | V03 S01 |
| DrugBank | DB00974 |
| PubChem | 6049 |
| ChEBI | 42191 |
| No E | E385 (Ca, Na) E386 (Na) |
| SMILES | |
| InChI | |
| Apparence | solide incolore à blanc, inodore[4] |
| Propriétés chimiques | |
| Formule | C10H16N2O8 [Isomères] |
| Masse molaire[5] | 292,242 6 ± 0,011 9 g/mol C 41,1 %, H 5,52 %, N 9,59 %, O 43,8 %, |
| pKa | 2,0 ; 2,7 ; 6,2 ; 10,3[6] |
| Propriétés physiques | |
| T° fusion | 245 °C (décomposition)[7] |
| Solubilité | 1 g·L-1 (eau, 25 °C)[7] 400 mg·L-1 (eau, 20 °C)[4] |
| Masse volumique | 0,86 g·cm-3 (20 °C)[4] |
| T° d'auto-inflammation | > 200 °C[4] |
| Point d’éclair | > 100 °C[4] |
| Pression de vapeur saturante | < 0,013 mbar (20 °C)[4] |
| Précautions | |
| SIMDUT[8] | |
 D2B, |
|
| Directive 67/548/EEC | |
| Écotoxicologie | |
| DL50 | 30 mg·kg-1 (souris, oral) 28,5 mg·kg-1 (souris, i.v.) 250 mg·kg-1 (souris, i.p.)[7] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'EDTA comporte six sites basiques, quatre correspondant aux bases conjuguées (carboxylates) des fonctions carboxyliques et deux correspondant aux fonctions amines. Ces sites basiques sont également des sites de complexation, faisant de l'EDTA un ligand hexadentate (ou parfois tétradentate, lorsque seuls les sites carboxyliques sont utilisés). C'est d'ailleurs sa principale caractéristique, son fort pouvoir chélatant (ou complexant) par lequel il forme des complexes métalliques très stables, ce qui en fait un traitement en cas d'intoxication aux métaux lourds comme le plomb, avec une concentration adaptée (voir Applications et chélation). Dans les complexes, l'EDTA est lié aux cations métalliques sous la forme d'une de ses bases conjuguées[10][source insuffisante]. Il a été synthétisé en 1935 par Ferdinand Münz[11].
Applications
L'EDTA s'utilise dans de nombreuses applications, par exemple dans l'industrie du papier, la photographie ou les industries de l'hygiène et l'alimentaire (antioxygène, agent de conservation et séquestrant E385[12]). En raison de sa toxicité, la concentration est évidemment adaptée à l'usage. L'EDTA est utilisé pour traiter des eaux (par exemple dans les lessives), pour éviter les précipitations (entartrage).

En chimie et papeterie, l'EDTA est utilisé pour doser par complexométrie les ions métalliques en solution (T.H.).
En biochimie, l'EDTA est utilisé comme inhibiteur des métalloenzymes. Son utilisation est très fréquente dans la purification des acides nucléiques (ADN ou ARN) et des protéines (voir tampon TAE et tampon TBE). En séquestrant en particulier les ions magnésium Mg2+, il bloque l'activité de nombreuses nucléases qui sont dépendantes de cet ion. L'EDTA est également un inhibiteur des métalloprotéases à zinc et limite ainsi l'hydrolyse des protéines dans les extraits cellulaires. En génie biologique, l'EDTA est utilisé en routine pour stopper l'activité de polymérases, la chélation des cations magnésium (Mg2+) modifiant la conformation des enzymes.
En médecine, l'EDTA, en formant des chélates ferriques (du fer (III)), permet de lutter contre l'hypersidérose (surcharges tissulaires en fer). Des complexes de l'EDTA peuvent être utilisés aussi pour traiter les intoxications par métaux lourds[13], saturnisme notamment, mais ces traitements provoquent des effets secondaires de façon très fréquente. Un test de plomburie dit « provoquée par EDTA calcidiso-dique » permet d'affirmer le diagnostic de saturnisme plus efficacement qu'une analyse de sang ou d'urine classique car il donne un indice de la dose interne de plomb biologiquement actif et mobilisable[14]. L'EDTA est aussi un conservateur de collyres, en conjonction avec d'autres conservateurs tels que le thiomersal ou le chlorure de benzalkonium[15]. L'EDTA est aussi utilisé comme anticoagulant, notamment dans les tubes de sang, puisqu'il capte les ions Ca2+ qui sont un facteur important de la coagulation.
En odontologie, l'EDTA est utilisé pour la déminéralisation endocanalaire lors de traitement endodontique.
En agronomie, l'EDTA est un chélateur capable de faire rentrer certains éléments nutritifs dans la plante. Un ajout d'EDTA dans un sol permet de lutter contre les carences en oligo-éléments.
Dans le domaine de l'agroalimentaire et de la cosmétique, l'EDTA est utilisé comme stabilisateur de produit vis-à-vis de la dégradation par les bactéries (fermentation). Comme les complexes métalliques de l'EDTA sont nettement plus stables que ceux dérivés de ligands protéiques, les cations métalliques deviennent indisponibles pour les micro-organismes pour lesquels ils sont essentiels, d'où une inhibition de la croissance bactérienne.
Dans l'industrie nucléaire (ou suite d'un accident nucléaire), l'EDTA peut être utilisé pour la manipulation[16] ou la décontamination de radionucléides. La chélation des radionucléides favorise en effet leur migration dans le milieu, y compris géologique lors du stockage définitif des déchets (à l'inverse du but de confinement recherché ; pour cette raison, la quantité d'EDTA par colis stocké est réglementée par les critères d'acceptation des déchets dans la plupart des pays, et l'usage de produits de décontamination non-complexant ou non-chélatant doit être recherché).
Toxicité
L’EDTA est une substance qui complexe les métaux lourds et qui, complexée, peut se fixer dans un organisme et est difficilement biodégradable. Cet acide n’est pas éliminé par les stations d’épuration et est donc rejeté dans les rivières et les lacs. De plus, comme l’EDTA n’est pas retenu par les filtres à charbon actif, il peut contaminer l'eau potable[17].
En tant qu'agent chélatant, l'EDTA « retire » les ions calcium de la salive. Il y perturbe donc l'équilibre ionique et contribue à la dissolution de l'hydroxyapatite dentaire[18].
L'Écolabel européen interdit l'EDTA dans les produits certifiés dans une des 6 catégories de détergents[19].
Formes et dérivés chimiques
L'EDTA (numéro CAS , mais d'autres numéros sont aussi déclarés : , , etc.) est produit sous différentes formes, acide libre ou sels. Les sels sodique (Na) et de potassium (K) mais aussi ferrique (Fe) sont les plus couramment employés.
Il est aussi la base de très nombreux dérivés, aux applications variées qui mettent en général à profit le pouvoir chélatant de l'EDTA vis-à-vis des ions divalents. Par exemple dans le DMNP-EDTA, utilisé en biologie pour étudier des cellules vivantes, l'EDTA chélate le calcium ou d'autres ions, tandis que le DMNP est un groupe photolabile (à 325 nm) qui permet d'augmenter ou diminuer la concentration ionique dans les cellules, afin d'étudier les signaux calciques cellulaires (ou le métabolisme du calcium)[20].
Des analogues de l'EDTA existent, par exemple l'EGTA qui comporte un motif ÉthylèneGlycol entre les deux amines et présente une plus grande spécificité de liaison avec le calcium[21].
| Composé | Numéro CAS | Composé | Numéro CAS |
|---|---|---|---|
| EDTA-AA | 105028-29-3 | AA-EDTA | - |
| EDTA acid | 94108-75-5 | ||
| EDTA-Azophényl | 53641-65-9 | Azophényl-EDTA | 53641-65-9 |
| EDTA-Benzy | 106145-38-4 | Benzyl-EDTA | 106145-38-4 |
| EDTA-Bitc | - | Bitc-EDTA | 94344-71-5 |
| EDTA-Calcium | 62-33-9 | Calcium EDTA | 7732-93-6 |
| EDTA-Ca-10 | 62-33-9 | EDTA-Ca-10 | 62-33-9 |
| EDTA-Cérium | 15158-67-5 | Ce EDTA | - |
| EDTA-Chrome (Cr) | - | Cr EDTA | - |
| EDTA-51Cr | 11063-42-6 | Cr-51 EDTA | 11063-42-6 |
| EDTA-Cobalt | - | Di Cobalt EDTA | 71-02-3 |
| EDTA-Cu-15 | 14025-15-1 | Cuivre EDTA | 51395-10-9 |
| EDTA-Ddmdp-LN | - | Ddmdp-LN-EDTA | 128480-86-4 |
| EDTA-DMNP | - | DMNPEDTA | - |
| EDTA-Emcs-Bz | - | Emcs-Bz-EDTA | 55015-71-7 |
| EDTA-Fer (Fe) | - | ||
| EDTA-Fe(II) (fer ferreux) | 15651-72-6 | Fe(II)-EDTA | 15651-72-6 |
| EDTA-Fe (ferII) | 56174-59-5 | Fer ferreux(II) EDTA | 56174-59-5 |
| EDTA-Fe-7 | 68413-60-5 | Fer EDTA | 23-71-7 |
| EDTA-Fe-13 | 15708-41-5 | Fe(EDTA)(2-) | 15651-72-6 |
| EDTA-Fe (ferII) | 923-71-7 | ||
| EDTA-Fe(III) (fer ferrique) | 54959-35-2 | Fe(III)-EDTA | 15275-07-7 |
| EDTA-Fe(III) | 39019-76-6 | Fer(III) EDTA | 15275-07-7 |
| EDTA Fe (ferIII) | 54959-35-2 | Fer(III)-EDTA | 36670-04-9 |
| EDTA-Manganèse (Mn) | - | ||
| EDTA-Mn-13 | 15375-84-5 | EDTA-Mn 13 % | 15708-41-6 |
| EDTA-Nickel | 15708-55-1 | Ni-EDTA | - |
| EDTA-pBAB [1-(4-bromoacétamidobenzyl)] | - | Pbab-EDTA | 81677-64-7 |
| EDTA-Potassium | - | Potassium-EDTA | - |
| EDTA-2K | 25102-12-9 | EDTA-K | - |
| EDTA-3K | 17572-97-3 | ||
| EDTA-Sodium (Na) | 8013-51-2 | Sodium-EDTA | 013-51-2 |
| EDTA-DiSodium | 139-33-3 | Na2 EDTA | 69772-70-9 |
| EDTA-TriSodium | - | TriSodium EDTA | 97928-92-2 |
| EDTA-Na2 | 6381-92-6 | EDTA-2Na | 139-33-3, 6381-92-6 |
| EDTA-TEA (TriÉthanolAmine) | - | EDTA-TEA | 60544-70-9 |
| EDTA-Zinc (Zn) | 92143-36-7 | Zinc-EDTA | 92143-36-7 |
| EDTA-Zn-15 | 14025-21-9 | Zn EDTA | 14025-21-9 |
Culture populaire
L'EDTA est présent dans le film Blade, dans lequel il est présenté comme étant violemment mortel contre les vampires.
Notes et références
Voir aussi
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.