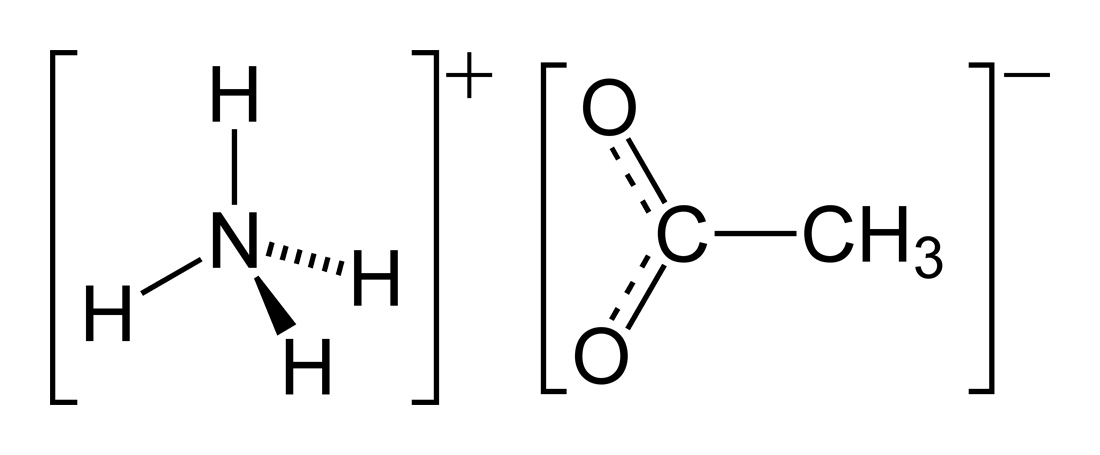
L'acétate d'ammonium est un sel azoté de formule brute C2H7NO2 (formule semi-développée CH3COONH4). C'est un solide blanc qui peut être obtenu par la réaction entre l'ammoniac et l'acide acétique.
| Acétate d'ammonium | |

| |
| Identification | |
|---|---|
| Nom UICPA | Acétate d'ammonium |
| No CAS | |
| No ECHA | 100.010.149 |
| No CE | 211-162-9 |
| No E | E264 |
| SMILES | |
| InChI | |
| Apparence | Cristaux déliquescents ou masse cristalline, odeur d'acide acétique. |
| Propriétés chimiques | |
| Formule | C2H7NO2 [Isomères] |
| Masse molaire[1] | 77,082 5 ± 0,002 9 g/mol C 31,16 %, H 9,15 %, N 18,17 %, O 41,51 %, |
| Propriétés physiques | |
| T° fusion | 114 °C |
| T° ébullition | décomposition |
| Solubilité | Librement sol. dans l'alcool; Légèrement sol. dans l'acétone; |
| Masse volumique | 1,07 g·cm-3 |
| Précautions | |
| SIMDUT[2] | |
Produit non contrôlé |
|
| Directive 67/548/EEC | |
| Écotoxicologie | |
| DL50 | 736 mg·l-1 rat par ingestion |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Historique
Caractérisation et propriétés physico-chimiques
L'acétate d'ammonium est un composé hygroscopique et se décompose à haute température (170 degré au reflux)pour former l'acétamide :
La solution d'acétate d'ammonium (CAS ), appelée esprit de Mindererus, est un liquide incolore et limpide. Il est préparé à partir d'1 g de carbonate d'ammonium et de 20 ml d'acide acétique dilué (6 %). Il contient 6,5 à 7,5 % de CH3COONH4.
Production et synthèse
Préparé à partir de l'acide acétique et de NH3.
Utilisation
En tant que sel d'un acide et d'une base faibles, il a certaines propriétés remarquables.
- Parfois employé comme un agent dégivrant.
- Souvent utilisé avec l'acide acétique (vinaigre) pour créer une solution tampon, qui peut être thermiquement décomposée en composés non-ioniques.
- Utile dans la condensation de Knoevenagel en synthèse organique.
- Agent de dosage analytique.
- Agent de préservation alimentaire, notamment des viandes (E264).
- Il est utilisé pour séparer PbSO4 des autres sulfates.
- Utilisé comme agent extincteur pour la classe F (auxiliaires de cuisson).
Notes et références
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.