Koordinaatiosidos
From Wikipedia, the free encyclopedia
Remove ads
Koordinaatiosidoksessa molekyylin tai ionin kaksi atomia jakavat sidoselektroniparin, joka on peräisin ainoastaan toiselta atomeista.[1] Koordinaatiosidos (engl. dative bond[2]) on kovalenttisen sidoksen erikoismuoto.
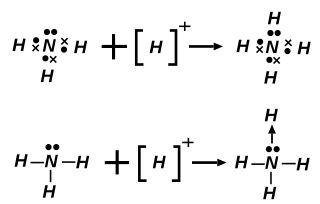
Kovalenttisessa sidoksessa atomeja yhdistää elektronipari siten, että molemmilta atomeilta tulee sidokseen yksi elektroni. Koordinaatiosidoksessa atomeita yhdistävät kaksi elektronia ovat peräisin samalta atomilta. Koordinaatiosidos ja kovalenttinen sidos ovat samankaltaisia kemiallisia sidoksia siten, että molemmat edellyttävät yhteisten elektroniparien jakamista kahden vierekkäisen atomin välillä. Koordinaatiosidos on kuitenkin kovalenttista sidosta merkittävästi polaarisempi, lujuudeltaan heikompi sekä pidempi.[2]
Remove ads
Koordinaatiosidoksen muodostuminen

Koordinaatiosidos muodostuu Lewisin emäksen eli elektroniparin luovuttajan ja Lewisin hapon eli elektroniparin vastaanottajan välille. Elektroniparin vastaanottavan atomin uloimmalla kuorella täytyy olla tilaa eli tyhjä orbitaali elektroniparia varten. Sidos muodostuu, kun Lewisin emäksen vapaa elektronipari asettuu tälle Lewisin hapon tyhjälle orbitaalille.[2]
Esimerkiksi Booritrifluoridilla BF3 ei ole jalokaasun rakennetta, vaan sen uloimmalla kuorella on vain kolme paria elektroneja. Tilaa on kuitenkin neljälle parille, eli oktetille[3]. Boorin uloimmalle kuorelle mahtuu siis vielä kaksi elektronia. Reaktiossa esimerkiksi ammoniakkimolekyylin kanssa typpi luovuttaa vapaan elektroniparinsa sidoksen muodostamiseksi[4].
Ammoniumionissa (NH4+) typpiatomin ja vetyatomin välinen koordinaatiosidos muodostuu elektroniparista, joka on peräisin typpiatomilta. Ammoniakkimolekyylissa NH3 typpiatomi muodostaa kolme tavallista kovalenttista sidosta vetyatomien kanssa. Typen jäljelle jäänyt, vapaa elektronipari muodostaa vielä neljännen sidoksen vetyionin H+ kanssa. Tämän neljännen sidoksen molemmat elektronit tulevat typeltä. Ammoniumionin muodostumisen jälkeen kaikki neljä sidosta ovat kuitenkin samanlaisia, eikä niiden sidostyyppiä voida enää erottaa toisistaan.[4]
Remove ads
Kompleksiyhdisteiden koordinaatiosidokset

Koordinaatiosidoksia esiintyy monissa siirtymämetallien yhdisteissä. Tällaista sidosta voidaan kuvata ligandin (Lewisin emäs), sekä metalli-ionin (Lewisin happo) vuorovaikutuksena. Ionit muodostavat kompleksiyhdisteitä siten, että metallikationiin sitoutuu yksi tai useampi ligandi, joka luovuttaa elektroniparin metallin ja ligandin väliseen sidokseen. Ligandeina voivat toimia monet epämetalleista muodostuneet atomiryhmät.[5]
Siirtymämetalleilla on voimakas taipumus kompleksiyhdisteiden muodostamiseen. Liuoksessa metallit muodostavat erilaisia koordinaatioyhdisteitä epäorgaanisten ja orgaanisten anionien sekä neutraalien molekyylien kanssa, ja koordinaatiosidosten luonne vaihtelee tapauskohtaisesti sähköisestä vuorovaikutuksesta kovalenttiseen sidokseen. Samassa liuoksessa voi samanaikaisesti esiintyä useita erilaisia, mutta samoista lähtöaineista muodostuneita kompleksiyhdisteitä.[6]
Vesiliuoksissa metalli-ioneihin sitoutuu yksi tai useampi vesimolekyyli, ja tällä tavoin syntyneitä kompleksi-ioneja on esimerkiksi vesiliukoisissa sinkki-ioneissa [Zn(H2O)4]2+ ja rautayhdisteissä [Fe(H2O)6]2+.[5] Vesimolekyylit kiinnittävät itsensä metalli-ioniin koordinaatiosidoksella. Metalli-ionin ja vesimolekyylin vuorovaikutuksesta kiteytyy erivärisiä suoloja riippuen yhdisteestä ja hapetusluvuista.[7]
Eräs esimerkki tapauksesta, jossa ligandit luovuttavat vapaan elektroniparinsa metalliselle keskukselle, on heksa-ammiinikoboltti(III)kloridi: jokainen ammoniakin ligandi lahjoittaa vapaan elektroniparinsa koboltti(III)-ioniin.
Ligandina voi olla myös jokin orgaaninen ryhmä, kuten esimerkiksi heterosyklinen yhdiste pyridiini nikkeli(II)tetrapyridiinidikloridissa Ni(C5H5N)4Cl2. Tässä pyridiinin typpiatomit ryhmittyvät nikkelin ympärille.[8]
Remove ads
Historia


Koordinaatioyhdisteitä on tunnettu jonkin verran jo 1700-luvulla[8], mm. preussinsininen, kaliumheksasyanoferraatti(II) K4[Fe(CN)6], oranssi heksa-ammiinikoboltti(III)kloridi [Co(NH3)6]Cl3[8] ja violetti penta-ammiiniklorokoboltti(III)kloridi [CoCl(NH3)5]Cl2. Heksa-ammiinikoboltti(III)kloridia valmistettiin 1798 kobolttikloridin vesiliuoksesta, johon oli lisätty ammoniakkia.[8]
Koordinaatiosidosten todellinen luonne ymmärrettiin kuitenkin vasta 1890-luvulla, jolloin nuori sveitsiläinen kemisti Alfred Werner (1866-1919) aloitti koordinaatiosidosten tutkimisen. Hän keksi että heksa-ammiinikoboltti(III)kloridissa ja vastaavissa yhdisteissä NH3 molekyylit ovat ryhmittyneet oktaedrimaisesti metalli-ionin ympärille. Hän esitti vuonna 1893 teorian, että siirtymämetallien ioneilla olisi kahdentyyppisiä valensseja. Primäärinen valenssi viittaa siihen, kuinka monta elektronia atomi luovuttaa tai vastaanottaa muodostaessaan ionisidoksia. Tätä kutsutaan nykyään hapetusluvuksi. Sekundäärinen valenssi taas viittaa metalli-ionin kykyyn muodostaa sidoksia Lewisin emäksien eli ligandien kanssa. Tätä kuvataan nykyään Wernerin käyttöön ottamalla koordinaatioluvulla.[9][7][8]
Lähteet
Aiheesta muualla
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
