From Wikipedia, the free encyclopedia
در شیمی، زمانی یک مولکول یا یک یون دستسان، دستوار یا اصطلاحا کایرال (به انگلیسی: Chiral) نامیده میشود که فارغ از میزان چرخش و نوع جابهجاییهای انجام شده، نتواند بر تصویر آینهای خود انطباقٰپذیر شود.[1][2][3][4]

دست انسان یکی از شناختهشدهترین مثال دستواری در جهان است. دست چپ، تصویر آینهای انطباقناپذیر دست راست است؛ صرف نظر از نحوهی چرخیدن دستها، غیرممکن است که ویژگیهای اساسی آنها برهم منطبق شود. این اختلاف در تقارن زمانی آشکار میشود که دستکش مربوط به دست چپ، بر روی دست راست قرار گیرد. واژهی دستواری از واژهی یونانی χειρ، (که به لاتین Chir نوشته میشود) به معنای «دست» گرفته شدهاست و رهیافتی ریاضی است بر مفهوم «دستوارگی».
در شیمی، دستواری معمولاً به مولکولها مربوط میشود. دو تصویر آینهای مربوط به یک مولکول دستوار، انانتیومر (پادهمسانپار) یا ایزومرهای نوری نامیده میشوند. هر جفت از انانتیومرها، غالباً به عنوان «راست دست» یا «چپ دست» نامگذاری میشوند.
دستواری مولکولی به دلیل کاربردهایش در شیمی فضایی، در قالب شیمی معدنی، شیمی آلی، شیمی فیزیک، بیوشیمی و شیمی فراذرهای دارای اهمیت است.
واژه فعالیت نوری از برهم کنش مواد دستوار با نور قطبیده گرفته شدهاست. در یک محلول، فرم-(−) یا فرم چیگرد یک ایزومر نوری، صفحه پرتو قطبیده را در خلاف جهت عقربههای ساعت چرخاند. فرم-(+) یا فرم راستگرد یک ایزومر نوری، عکس این کار را انجام میدهد؛ (صفحه پرتو را در جهت عقربههای ساعت میچرخاند). نور پلاریزه نخستین بار توسط جین-بپتیست بایو در سال ۱۸۱۵ آشکار شد،[5] و اهمیت قابل توجهی را در صنایع مختلف، شیمی تجزیه و داروسازی بدست آورد. لویی پاستور در سال ۱۸۴۸ با جداسازی بلورهای تارتاریک اسید، متوجه شد که دو نوع بلور بدست آمده در خواص شیمیایی کاملاً مشابه هم عمل میکنند اما در چرخش نور پلاریزه بر خلاف یکدیگر واکنش نشان میدهند. درحالی که مخلوط اولیه، هیچ چرخشی در نور پلاریزه ایجاد نمیکرد. او دریافت که این پدیده، منشأ مولکولی دارد و مخلوط شامل دو ایزومر نوری است که آنها را انانتیومر و مخلوط را راسمیک نامید.[6] مواد کامپوزیت مصنوعی که فعالیت نوری مشابهی را البته در محدوده ریزموج نشان میدادند، در سال ۱۸۹۸ توسط جاگادیش چاندرا بوز معرفی شدند[7] و توجهات بسیاری را از اواسط سال ۱۹۸۰ بدست آوردند.[8] واژه دستواری نخستین بار توسط لرد کلوین در سال ۱۸۹۴ بکار برده شد.[9] انانتیومر (پادهمسان پار) و دیاستیومر (میان فضا پار)های مختلف یک ترکیب را به دلیل تفاوت در ویژگیهای نوریشان، سابقاً ایزومرهای نوری مینامیدند.[10]
تقارن یک مولکول (یا هر موجود دیگر) تعیینکننده دستوار بودن یا نبودن آن است. چنانچه مولکولی تحت یک چرخش غیربدیهی، که ترکیبی از چرخش و بازتاب در صفحه عمود بر محور چرخش است، به مولکول یکسانی منجر شود؛ غیردستوار خواهد بود. – دستواری (در ریاضیات) را ببینید. در مولکولهای چهاروجهی، اگر هر چهار استخلاف متفاوت باشند، مولکول دستوار است.
یک مولکول دستوار الزاماً مولکولی نامتقارن (فاقد هر گونه اجزای متقارن) نیست؛ چنین مولکولی میتواند، برای مثال، تقارن چرخشی داشته باشد.
برای شیمیدانها، سیستم R / S مهمترین سیستم نامگذاری برای نمایش انانتیومرهاست که شامل مولکول مرجعی چون گلیسرآلدهید نمیشود. این روش نامگذاری هر مرکز کایرال را بر اساس سیستمی که توسط آن هر استخلاف با توجه به «قواعد اولویت بندی کان-اینگولد-پریلاگ» (مخفف انگلیسی: CIP) و بر پایه عدد اتمی اولویت معینی یافتهاست، با R و S برچسب گذاری میکند.

اگر مرکز به گونهای چرخیده شود که استخلاف دارای کمترین اولویت، دور از ناظر قرار گرفته باشد، ناظر با دو احتمال متفاوت روبرو خواهد بود: اگر اولویت سه استخلاف باقیمانده، در جهت عقربههای ساعت کاهش یابد، آن را با R (از واژه لاتین Rectus به معنای مستقیم) برچسب گذاری میکنند؛ و اگر اولویتها در خلاف جهت عقربههای ساعت کاهش یابند، آن را با S (از واژه لاتین Sinister به معنای چپ) برچسب مینهند.[11]
هر مرکز کایرال در یک مولکول (و حتی مولکولهای دستوار که فاقد مراکز کایرال هستند) را میتوان توسط این سیستم برچسب گذاری کرد؛ لذا این سیستم نسبت به سیستم D/L کلیت بیشتری دارد و میتواند، به عنوان مثال، یک ایزومر (R,R) را در مقابل یک دیاسترومر (R,S) برچسب گذاری کند.
سیستم R / S هیچ ارتباط معینی با سیستم (+)/(−) ندارند. یک ایزومر R بسته به استخلافش میتواند راستگرد یا چپگرد باشد.
سیستم R / S هیچ ارتباط معینی با سیستم D/L نیز ندارد. به عنوان مثال، زنجیره جانبی یک سرین (اسید آمینه) دارای یک گروه هیدورکسیل،OH، است. اگر یک گروه تیول،SH، جایگزین آن شود، نامگذاری D/L، بنابر تعریفش، متأثر از این تعویض نخواهد بود. اما این تعویض، نامگذاری R / S مولکول را معکوس خواهد کرد؛ چرا که بر اساس قاعده اولویت بندی CIP، اولویت CH2OH پایینتر از CO2H است، اما اولویت CH2SH بالاتر از CO2H است.
به دلیل آنکه داشتن برچسب دستواری یکسان برای تمامی ترکیبات متداول از یک ساختار داده شده در ارگانیزمهای بالاتر، کار راحت تری است، سیستم D/L در حوزههای معینی از بیوشیمی، همچون شیمی آمینو اسیدها یا کربوهیدارتها، استفاده مشترک دارد. در سیستم D/L تقریباً همه برچسب گذاریها مشابهاند- آمینو اسیدها همگی از نوع L و کربوهیدراتها همگی از نوع D هستند. در سیستم R / S، بیشترشان S هستند. البته استثناءهایی هم وجود دارد.
یک انانتیومر میتواند توسط جهتی که صفحه نور قطبیده را میچرخاند، نامگذاری شود. اگر انانتیومر، نور را (از نگاه ناظری که نور در مقابلش در حال حرکت است) در جهت عقربههای ساعت بچرخاند، خود انانتیومر را با (+) و تصویر آینهای آن را با (−) برچسب گذاری میکنند. ایزومرهای (+) و (-) به شکل d- و l- (به ترتیب برای حالت راستگرد(به انگلیسی: dextrorotatory) و چپگرد(به انگلیسی: levorotatory)) نیز برچسب زده میشوند. از آنجایی که نامگذاری به شیوه d- و l- به راحتی با نامگذاری به شیوه D- و L- اشتباه گرفته میشود، لذا شدیداً توسط آیوپاک (مخفف انگلیسی: IUPAC) توصیه میشود که از این روش استفاده نشود.[12]

یک ایزومر نوری میتواند توسط شکل فضایی اتمهایش نامگذاری شود. در مورد سیستم D/L (که نام آن از واژگان لاتین dexter و laevus به معنای راست و چپ گرفته شدهاست و نباید آن را با سیستم d- و l- که در بالا اشاره شد، اشتباه گرفت)، میتوان گفت که این نامگذاری با استفاده از ارتباط بین مولکول موردنظر و گلیسرآلدهید انجام شدهاست. گلیسرآلدهید، خود یک ترکیب دستوار است و دو ایزومر آن با D و L برچسب گذاری شدهاند.
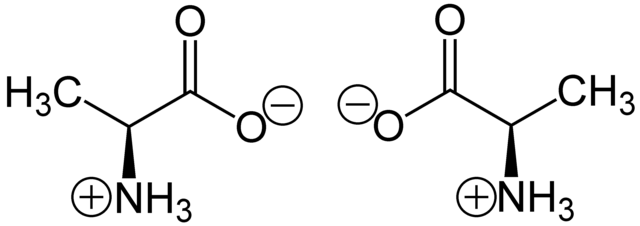
دستکاریهای شیمیایی خاصی میتواند بر گلیسرآلدهید اعمال شود، بدون آنکه تأثیری بر پیکربندی آن داشته باشد و استفاده تاریخی آن برای این منظور (علاوه بر مفید بودنش به عنوان یکی از کوچکترین مولکولهای پرکابرد دستوار) منجر به کاربردش در نامگذاری شدهاست. در این سیستم، ترکیبات در قیاس با گلیسرآلدهید، که بهطور کلی توصیفات بدون ابهامی را ایجاد میکند، نامگذاری میشوند. اما راحتترین راه، مشاهده این نامگذاریها در بیومولکولهای مشابه گلیسرآلدهید است. به عنوان مثال، آمینواسید آلانین که دارای دو ایزومر نوری است، بر اساس اینکه از کدام ایزومر گلیسیرآلدهید به وجود آمدهاند، برچسب زده میشوند. از سویی دیگر گلیسین که یکی از آمینواسیدهای گلیسرآلدهید است، هیچ فعالیت نوری ندارد و دستوار هم نیست؛ در حالیکه آلانین دستوار است.
سیستم برچسب گذاری D/L به سیستم (+)/(−) ارتباطی ندارد و نشان نمیدهد که کدام انانتیومر، راستگرد و کدام چپگرد است. گرچه ارتباط شیمی فضایی یک ترکیب، راستگردی یا چپگردی انانتیومر گلیسرآلدهید را مشخص میکند. ایزومر راستگرد گلیسرآلدهید، در واقع ایزومرD-است. ۹ عدد از ۱۹ آمینواسید L- که بهطور معمول در پروتئینها یافت میشوند، راستگرد هستند (در طول موج ۵۸۹ نانومتر) و فراکتوزD- (قند موجود در میوه جات) نیز چپگرد هستند.
یک قاعده کلی برای تعیین ایزومرهای D/L یک آمینواسید، قاعده "CORN" است: گروههای COOH و R وNH2 و H (که R در زنجیره جانبی است) در اطراف اتم کربن مرکزی دستوار، مرتب شدهاند. هنگامی که اتم هیدوژن دور از ناظر قرار گرفته باشد، اگر آرایش گروههای CO→R→N حول اتم کربن به عنوان مرکز، پادساعتگرد باشد؛ ایزومر از نوع L و اگر ساعتگرد باشد، از نوع D خواهد بود.[13] نوع L، ایزومر یافت شده در پروتئینهای طبیعی است. برای بیشتر آمینواسیدها، ایزومر نوع L مشابه یک شیمی فضایی مطلق S است، اما برای زنجیرههای جانبی، مشابه R است.
واژگان لاتین راست و چپ، به ترتیب dexter و laevus هستند. کلمات راست و چپ، همواره معانی ذهنیای را دارا بودهاند، و واژگان لاتین برای آنها Rectus و Sinister است. کلمه انگلیسی «راست» از واژه Rectus مشتق شدهاست. این منشأ حروف D,L و S,R بودهاست.
هر مخلوط دستوار غیرراسمیک را مخلوط اسکالمیک (Scalemic Mixture) نامیده میشود.[14]
یک ماده دستوار، زمانی که تنها یکی از دو انانتیومر آن حاضر باشند، یک انانتیوپر یا دستوار همگون نامیده میشود.
یک ماده دستوار، زمانی که مقدار مازادی از یک انانتیومر (البته نه در غیاب کامل انانتیومر دیگر) حاضر باشد، یک اناتیونریشد یا دستوار ناهمگون نامیده میشود.
فراوانی انانتیومری یا ee، (معیاری برای اندازهگیری میزان فراوانی یک انانتیومر نسبت به دیگری) معرفی میشود. به عنوان مثال، در یک نمونه با۴۰٪ ee در R، یعنی مقدار ۶۰٪ باقیمانده راسمیک است که شامل ۳۰٪ R و ۳۰٪ S است. بنابراین، کل مقدار R برابر ۷۰٪ خواهد بود.
بهطور کل، مولکولهای دستوار در یک اتم منفرد نامتقارن فضایی که چهار استخلاف مختلف دارد، دارای دستواری نقطهای هستند. گفته میشود که انانتیومرهای چنین ترکیباتی در اینگونه مراکز، پیکربندی مستقل و متفاوتی دارند؛ بنابراین این مرکز، از لحاظ فضایی نامتقارن است. (یعنی گروهی در داخل مجموعه مولکولی که میتواند به عنوان مانونی از ایزومرهای فضایی در نظر گرفته شود).
وقتی که یک اتم ۴ استخلاف متفاوت دارد معمولاً دستوار است. هر چند در برخی وارد نادر، دو لیگاند به دلیل تصویر آینهای یکدیگر بودن، با هم متفاوتند. در صورت بروز چنین اتفاقی، تصویر آینهای مولکول با خودش برابر بوده لذا مولکول غیر دستوار است. این مورد را شبه دستواری مینامند.
یک مولکول، بدون اینکه دستوار باشد، میتواند چندین مرکز فضایی نامتقارن داشته باشد. اگر بین دو مرکز (یا بیشتر) تقارن وجود داشته باشد، مولکول را ترکیب مزو مینامند.
ممکن است یک مولکول دستوار باشد بدون آنکه دستواری نقطهای داشته باشد. مثالهای متداول از این مورد عبارتند از: ۱٬۱'-بی-۲-نفتول(مخفف انگلیسی: BINOL)، ۱٬۳-دی کلرو آلن و BINAP که دستواری محوری دارند. (E)-سیکلواکتن که دستواری صفحهای دارد؛ کالیزرنها و فولرنها که دستواری ذاتی دارند. اگر یک مولکول شامل زیرواحدی چهارضلعی باشد که به آسانی قابل بازآرایی نباشد، برای مثال ۱-برومو-۱-کلرو-۱-فلوئوروادمنتین و متیل اتیل فنیل تتاهدرین، نوعی از دستواری نقطهای بوقع میپیوندد.
مهم است که بخاطر داشته باشیم مولکولها از انعطافپذیری بالایی برخوردارند و بنابراین، بسته به محیط، میتوانند ساختارهای گوناگونی داشته باشند. این ساختارهای گوناگون تقریباً همیشه دستوار هستند. در ارزیابی دستواری، یک ساختار میانگین-زمانی در نظر گرفته میشود. برای ترکیبات عادی باید به متقارنترین ساختار ممکن رجوع کرد.
در اندازهگیریهای تجربی، هنگامی که چرخش نوری یک انانتیومر بسیار کم باشد، گفته میشود که انانتیومر دستواری نهانی را به نمایش میگذارد.
در بررسی دستواری، حتی تفاوتهای ایزوتوپی هم باید لحاظ شوند. جایگزینی یکی از دو اتم 1H در موقعیت CH2 بنزیل الکل با یک دوتریوم (2H)، کربن مربوطه را به یک مرکز نامتقارن فضایی تبدیل میکند. بنزیل-α-dالکل حاصله به شکل دو انانتیومر مشخص وجود دارد که توسط قراردادهای نامگذاری متداول در شیمی فضایی، نامگذاری شدهاند. انانتیومر نوع S، [α]D = +۰٫۷۱۵° دارد.[15]
مانند بسیاری از مولکولهای زیستی، اتم نامتقارن فضایی در مولکولهای دستوار، معمولاً کربن است. اگرچه (مثل بیشتر ترکیبات کمپلکس دستوار)، این اتم میتواند یک اتم فلزی، نیتروژن، فسفر یا گوگرد نیز باشد.
| اتم دستوار | کربن | نیتروژن | فسفر (فسفاتها) | فسفر (فسفینها) | گوگرد | فلز (نوع فلز) |
|---|---|---|---|---|---|---|
| ۱ مرکز نامتقارن فضایی | سیرین، گلیسرآلدهید | سارین، وی ایکس) | اس امپرازول، ارمودافینیل | تریس (بی پیریدین) روتنیم (II) کلرید، سیس-دیکلروبیس (اتیلندیآمین) کبالت(III) کلرید، هگزول (کبالت) | ||
| ۲ مرکز نامتقارن فضایی | ترئونین، ایزولوسین | بازتروگر | آدنوزین تریفسفات | دیآیپیایامپی | دیتیونوس اسید | |
| ۳ مرکز نامتقارن فضایی یا بیشتر | مت-انکفالین، لئو-انکفالین | دی ان ای |
دو انانتیومر مربوط به یک مولکول عموماً مشابه یکدیگر رفتار میکنند. به عنوان مثال، در کروماتوگرافی لایه نازک، هر دو با Rf یکسان مهاجرت میکنند و در HPLC هر دو دارای زمان ماند مشابهند. طیف رزونانس مغناطیسی هستهای (مخفف انگلیسی: NMR) و طیف بینی فروسرخ (مخفف انگلیسی: IR) آنان نیز یکسان است. به هر حال، انانتیومرها در حضور دیگر مولکولها و موجودات دستوار، به گونه متفاوتی رفتار میکنند. مثلاً انانتیومرها در محیطهای کروماتوگرافی دستوار، همچون کوارتز یا محیط استانداردی که از نظر دستواری اصلاح شده، بهطور یکسان مهاجرت نمیکنند. طیف رزونانس مغناطیسی هستهای انانتیومرها، توسط یک انانتیومر دستوار منفرد افزوده شده، مثل ای یو اف او دی(مخفف انگلیسی: EuFOD)، بهطور متفاوتی تحت تأثیر قرار میگیرند.
ترکیبات دستوار صفحه نور قطبیده را میچرخانند. هر انانتیومر نور را در جهت خاصی، ساعتگرد یا پادساعتگرد، میچرخاند. مولکولهایی که چنین رفتاری دارند را اصطلاحاً گفته میشود که از لحاظ نوری فعالند.
انانتیومرهای مختلف یک ترکیب دستوار، اغلب طعمها و بوهای متفاوتی نیز دارند و به عنوان دارو هم تأثیرات متفاوتی خواهند داشت. این اثرات، دستواری ذاتی در سیستمهای زیستی را نشان میدهد.
نور قطبیده دایروی موجود دستواری است که با هر یک از انانتیومرهای یک ترکیب دستوار بهطور متفاوتی برهم کنش میکند: یک انانتیومر، نور قطبیده دایروی راستگرد یا چپگرد را با درجات متفاوتی جذب خواهد کرد و این اساس طیفسنجی در رنگ تابی دورانی (مخفف انگلیسی: CD) است. تفاوت در میزان جذب، معمولاً مقدار کوچکی است (قسمت بر هزار). طیفسنجی رنگ تابی دورانی[16] یک روش آنالیز قدرتمند برای بررسی ساختار ثانویه پروتئینها و تعیین پیکربندی دقیق ترکیبات دستوار، علیالخصوص، کمپلکسهای فلز واسطه است. طیفسنجی رنگ تابی دورانی در حال جایگزینی قطبش سنجی به عنوان روشی برای شناسایی ترکیبات دستوار است، اگرچه روش دوم همچنان در میان شیمیدانان در زمینههای قند و کربوهیدراتها، کابرد دارد.
بسیاری از مولکولهای فعال زیستی شامل آمینواسیدهای طبیعی (پایههای سازنده پروتئینها) و قندها، دستوار هستند. در سیستمهای زیستی، بسیاری از این ترکیبات دارای دستواری یکسان هستند: بیشتر آمینواسیدها L و قندها D هستند. پروتئینهای طبیعی متداول چنانچه از آمینواسیدهای L ساخته شده باشند را به عنوان پروتئینهای چپ-دست شناخته میشوند؛ در حالیکه آمینواسیدهای D، پروتئینهای راست-دست تولید میکنند.
منشأ این دستواری همگون در زیست، موضوع بحثهای بسیاری است.[17] بسیاری از دانشمندان معتقدند که «انتخاب» دستواری در حیات زمینی، کاملاً تصادفی بوده و اگر انواعی از حیات زمینی مبتنی بر کربن در جای دیگری از جهان وجود داشته باشد، از نظر تئوری، شیمی آنها میتواند از دستواری متضادی برخوردار باشد. به هر حال، پیشنهادهایی وجود دارد مبنی بر اینکه آمینواسیدهای اولیه میتوانستند به شکل گرد و غبار دنبالهدار تشکیل یابند. در این حالت، تابش قطبیده دایروی (که ۱۷٪ تابش ستارهای را ناشی میشود) میتواند موجب تخریب انتخابی دستواری آمینو اسیدها شود که منجر به انتخابی میشود که نتیجه ان دستواری همگون برای کل حیات برای کره زمین است.[18]
آنزیمها، که خود موجوداتی دستوار هستند، اغلب انانتیومرهای یک زیرلایه دستوار را از هم تمییز میدهند. آنزیمی را با حفرهای دستکش-مانند تصور کنید که یک زیرلایه را محصور میکند. اگر این دستکش مربوط به دست راست باشد، پس یک انانتیومر در داخل آن جای خواهد گرفت و محصور خواهد شد، در حالیکه انانتیومر دیگر به این شکل نیست و تمایل کمتری به محصور شدن دارد.
آمینواسیدهای نوع D- طعمهای شیرین دارند، حال آنکه نوع L- معمولاً بیمزه هستند.[19] برگ نعنا و دانه زیره سیاه، به ترتیب انانتیومرهای کاروونR-(–)- و کاروونS-(+)- را دارا هستند.[20] از آنجا که گیرندههای بویایی ما شامل مولکولهای دستواری است که در حضور انانتیومرهای مختلف، به گونه متفاوتی رفتار میکنند، این دو برای اغلب انسانها بوهای متفاوتی دارند.
دستواری در زمینه فازهای مرتب شده نیز حائز اهمیت است. برای مثال افزایش مقدار اندکی از یک مولکول فعال نوری به یک فاز نماتیک (فازی که دارای مولکولهایی با جهتگیری بلند-برد هستند)، آن فاز را به یک فاز نماتیک دستوار (یا فاز کلستریک) تبدیل میکند. دستواری در زمینه چنین فازهایی در شارههای پلیمری نیز مورد مطالعه قرار گرفتهاست.[21]
فراوانیهای نسبی هر یک از D-ایزومرهای مختلف آمینواسیدهای گوناگون، به تازگی با گردآوری دادههای تجربی پروتئومهای همه موجودات زنده در پایگاه داده سوئیس-پرات (Swiss-Prot database) اندازهگیری شدهاست. همانطور که در جدول زیر دیده میشود، D-ایزومرهایی که در آزمایشگاه مشاهده شدهاند، به ندرت در پایگاه داده توالی پروتئینها که شامل بیش از ۱۸۷ میلیون آمینواسید است، وجود دارند.[22]
به هر حال، مثل آمینواسیدهای آزاد، D-ایزومرها کمیاب نیستند. انسانها آنزیمهای خاصی دارند: D-آمینواسید اکسیداز، D-اسپاتریت اکسیداز، D-گلوتامیک اسید، D-گلوتامین و D-آلانین در قسمتی از لایه پپتیدوگلیکان دیواره سلول باکتریها بسیار شایعند. بعلاوه، D-سرین یک انتقال دهنده عصبی است و بواسطه «سرین رسمیس» در انسان تولید میشود.

بسیاری از کمپلکسهای شیمیایی دستوار هستند. زمانی، دستواری تنها مربوط به شیمی آلی میشد، اما این باور غلط، با تجزیه یک ترکیب کاملاً غیرآلی، هگزول، توسط آلفرد ورنر کنار گذاشته شد. یک مثال معروف، تریس (بی پیریدین) روتنیم (II) کلرید است که در آن سه لیگاند «بی پیریدین» یک آرایش پروانه مانند را اتخاذ میکنند.[23] در این حالت، اتم روتنیم (Ru) مرکز نامتقارن فضایی خواهد بود. دو انانتیومر کمپلکسی چون [روتنیم(۲٬۲′-بی پیریدین)۳]۲+ با علامت Λ (لاندای بزرگ، نسخه یونانی"L") برای چرخش چپگرد پروانه توصیف شده توسط لیگاندها، وبا علامت Δ (دلتای بزرگ، نسخه یونانی "D") برای چرخش راستگرد مشخص میشوند.
هنگامی که یک جفت ناپیوندی از الکترونها، تک جفت منفرد، فضایی برا اشغال میکند، دستواری حاصل میشود. این اثر در بعضی آمینها، فسفینها،[24] سولفونیومها، یونهای اکسینیوم، سولفوکسیدها و حتی کربانیونها فراگیر است. نیاز اصلی، غیر از وجود تک جفت منفرد، آن است که سه استخلاف دیگر، دو به دو با یکدیگر متفاوت باشند. لیگاندهای فسفین دستوار در سنتز نامتقارن مفید است.
آمینهای دستوار به دلیل آنکه انانتیومرهایشان به ندرت میتوانند از هم جدا شوند، خاصند. سد انرژی برای وارونگی نیتروژن یک مرکز فضایی، معمولاً چیزی حدود ۳۰ کیلوژول/ مول است و بدین معناست که ایزومرهای فضایی در دمای اتاق سریعاً به هم تبدیل میشوند. نتیجه آنکه چنین آمینهای دستواری نمیتوانند به انانتیومرهای منفردی تفکیک شوند، مگر آنکه برخی از استخلافها در ساختارهای چرخهای، مثل باز تروگر مقید باشند.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.