From Wikipedia, the free encyclopedia
پروتئین ۲ مستعدکننده به سرطان پستان (انگلیسی: Breast cancer type 2 susceptibility protein) که بیشتر با نام اختصاری BRCA2 شناخته میشود (بخوانید: بِـرَکا توو؛ /ˌbrækəˈtuː/[۴]) یک پروتئین است که در انسان توسط ژن «BRCA2» کُدگذاری میشود. این پروتئین با نام «بِـرَکا توو، مرتبط با ترمیم دیانای» هم شناخته میشود که این نام جدید از سوی کمیته نامگذاری ژن هوگو انتخاب شده است. پروتئین همسان آن در سایر مهرهداران «Brca2» است[۵][۶] (با حروف کوچک انگلیسی). ژن «BRCA1» در انسان، یک ژن سرکوبگر تومور است[۷][۸] و پروتئین حاصل از آن، در ترمیم آسیبهای دیانای نقش مهمی دارد.[۹]
BRCA2 و BRCA1 معمولاً در سلولهای پستان و سایر بافتها بیان میشوند و در آنجا به ترمیم دیانای آسیبدیده کمک میکنند یا اگر دیانای قابل ترمیم نباشد، سلولها را از بین میبرند. آنها در ترمیم آسیبهای کروموزومی با تأکید ویژه بر «بازسازی دیانای بدون خطا» هنگام شکستگیهای دو رشتهٔ دیانای نقش مهمی دارند.[۱۰][۱۱] اگر خود ایندو ژن حیاتی بدن در اثر جهش آسیب ببیند، دیانای آسیبدیده بهدرستی ترمیم نمیشود و این موضوع خطر ابتلا به سرطان پستان را افزایش میدهد.[۱۲][۱۳] هر دوی این ژنها به عنوان «ژنهای مستعدکننده به سرطان پستان» و «پروتئینهای مستعدکننده به سرطان پستان» توصیف شدهاند. الل غالب دارای عملکرد طبیعی سرکوب کننده تومور است در حالی که جهشهای با نفوذ بالا در این ژنها باعث از دست دادن عملکرد سرکوبگر تومور در آنها میشود که با افزایش خطر ابتلا به سرطان پستان همراه است.[۱۴]
ژن BRCA2 روی بازوی بلند کروموزوم ۱۳ در موقعیت ۱۲٫۳ قرار دارد.[۱۵] ژن مرجع BRCA2 انسانی شامل ۲۷ اگزون است و دیانای مکمل آن دارای ۱۰٬۲۵۴ جفتباز است[۱۶] که پروتئینی با ۳۴۱۸ اسید آمینه را کُدگذاری میکند.[۱۷][۱۸]

اگرچه ساختار ژنهای BRCA2 و BRCA1 بسیار متفاوت است، اما دستکم برخی از عملکردهای آنها به یکدیگر مرتبط هستند. پروتئینهای ساخته شده توسط هر دو ژن برای ترمیم دیانای آسیبدیده ضروری هستند (شکل مراحل ترمیم نوترکیبی را ببینید). پروتئین BRCA2 به دیانای تکرشتهای متصل میشود و بهطور مستقیم با آنزیم ریکامبیناز RAD51 برای تحریک[۲۶] و حفظ[۲۷] «یورش رشتهای»، یک مرحله حیاتی از نوترکیبی همساخت تعامل میکند. تخصیص موضعی RAD51 به شکستگیهای دورشتهای دیانای مستلزم تشکیل کمپلکس شیمیایی BRCA1-PALB2-BRCA2 است. پروتئین PALB2 (همکار و موضعیساز BRCA2)[۲۸] میتواند بهطور همافزایی با کیمارای BRCA2 (که پیکولو یا piBRCA2 هم نامیده میشود) برای گستراندن بیشتر «یورش رشتهای» همکاری کند.[۲۹] این شکستگیها ممکن است ناشی از تشعشعات طبیعی و پزشکی یا سایر عوامل آسیبرسان محیطی باشد، اما همچنین زمانی رخ میدهد که کروموزومها مواد ژنتیکی را طی یک نوع تقسیم سلولی خاص که اسپرم و تخمک ایجاد میکند (میوز) مبادله میکنند. شکستگیهای دو رشتهای نیز در طی ترمیم پیوندهای متقابل دیانای ایجاد میشود. بهطور کلی، این پروتئینها با ترمیم دیانای، در حفظ ثبات ژنوم انسان نقش دارند و از بازآرایی ژنی خطرناکی که میتواند منجر به سرطانهای خونی و سایر سرطانها شود، جلوگیری میکنند.
پژوهشگران نشان دادهاند که پروتئین BRCA2 نقش مهمی در محافظت در برابر تخریب هستهای وابسته به MRE11 توسط «چنگالهای معکوس» دارد که در طول توقف چنگال همانندسازی دیانای (ناشی از اِشکالاتی چون جهشها، مولکولهای جاگذار و غیره) تشکیل میشوند.[۳۰]
همچون BRCA1، پروتئین BRCA2 نیز احتمالاً فعالیت سایر ژنها را تنظیم میکند و نقش مهمی در رشد جنین ایفا میکند.

تغییرات خاصی در ژن BRCA2 خطر ابتلا به سرطان پستان را بهعنوان بخشی از سندرم ارثی سرطان پستان-تخمدان افزایش میدهد. پژوهشگران صدها جهش در این ژن را شناسایی کردهاند که بسیاری از آنها باعث افزایش خطر ابتلا به سرطان میشوند. جهشهای BRCA2 معمولاً بهصورت درج یا حذف تعداد کمی از جفتبازهای دیانای در ژن هستند. در نتیجهٔ این جهشها، محصول پروتئینی ژن BRCA2 غیرطبیعی است و به درستی عمل نمیکند. پژوهشگران بر این باورند که پروتئین معیوب BRCA2 قادر به رفع آسیب دیانای در سراسر ژنوم نیست. در نتیجه، به دلیل سنتز ترانسلیون مستعد خطا و آسیبهای دیانای ترمیمنشده، میزان جهشها افزایش مییابد و برخی از این جهشها میتوانند باعث تقسیم سلولها به روش کنترلنشده و تشکیل تومور شوند.
افرادی که دو نسخه جهش یافته از ژن BRCA2 دارند، دچار نوعی آنمی فانکونی هستند. این وضعیت به دلیل کاهش بسیار زیاد پروتئین BRCA2 در سلولها ایجاد میشود که امکان تجمع دیانای آسیب دیده را فراهم میکند. بیماران مبتلا به کمخونی فانکونی مستعد ابتلا به انواع مختلفی از سرطان خون و همچنین تومورهای توپُر بهویژه سرطانهای سر و گردن، سرطان پوست، بدخیمیهای اندامهای تناسلی؛ و نارسایی مغز استخوان (کاهش تولید سلولهای خونی که منجر به کم خونی میشود) هستند. زنانی که ژن معیوب BRCA1 یا BRCA2 را به ارث بردهاند، خطر ابتلا به سرطان پستان و سرطان تخمدان را دارند که این خطر آنچنان بالا و انتخابی است که بسیاری از حاملان جهش ژنی، جراحیهای پیشگیرانه و برداشتن تخمدان و بافت پستان را انتخاب میکنند. حدسهای زیاد و بهظاهر قابل توجهی برای توضیح چنین ویژگی بافتی وجود دارد. عوامل تعیینکننده اصلی محل وقوع سرطانهای ارثی مرتبط با BRCA1 و BRCA2 به ویژگی بافتی پاتوژن سرطان، عاملی که باعث التهاب مزمن میشود، یا عامل سرطانزا مربوط میشود. بافت هدف ممکن است گیرندههایی برای پاتوژن داشته باشد که آن را بهطور انتخابی در معرض مواد سرطانزا و یک فرایند عفونی قرار میدهد. نقص درونزاد ژنومی پاسخهای طبیعی را مختل میکند و حساسیت به بیماری را در اعضای هدف تشدید میکند. این نظریه همچنین با برخی دادهها دربارهٔ چندین سرکوبگر تومور دیگر مطابقت دارد. مزیت اصلی این مدل پشنهادی آن است که پزشکان را به فکر میاندازد که علاوه بر جراحی پیشگیرانه، گزینههای دیگری نیز وجود دارد.[۳۲]
علاوه بر سرطان پستان در مردان و زنان، جهش در ژن BRCA2 همچنین منجر به افزایش خطر ابتلا به سرطان تخمدان، لوله رحم، پروستات و لوزالمعده میشود. در برخی از مطالعات، جهش در بخش مرکزی ژن با خطر بالاتر سرطان تخمدان و خطر کمتر سرطان پروستات نسبت به جهش در سایر بخشهای ژن مرتبط بوده است. در برخی خانواده چندین نوع سرطان دیگر نیز در اثر جهش BRCA2 دیده شده است.
بهطور کلی، جهشهای شدید ارثی (از جمله جهشهای در BRCA2) تنها ۵ تا ۱۰ درصد از موارد سرطان پستان را تشکیل میدهند. میزان خطر خاص در ابتلا به سرطان پستان یا سایر سرطانها در افرادی که دچار جهش BRCA2 هستند به عوامل زیاد دیگری بستگی دارد.[۳۳]
ژن BRCA2 در سال ۱۹۹۴ کشف شد.[۱۵][۳۴][۳۵] در سال ۱۹۹۶، کنث آفیت و گروه پژوهشی او در مرکز سرطان مموریال اسلون–کترینگ با موفقیت شایعترین جهش را در ژن مرتبط با سرطان پستان و تخمدان در میان افراد یهودیتبار اشکنازی شناسایی کردند.[۳۶][۳۷][۳۸][۳۹]
این ژن نخستین بار توسط دانشمندان «میریاد جنتیکس»، «شرکت اِندو»، «گروه مشارکت محدود پژوهش و توسعه اچاسسی» و دانشگاه پنسیلوانیا شبیهسازی شد.[۴۰]
روشهای تشخیص احتمال ابتلا به سرطان در بیمار مبتلا به جهشهای BRCA2 و BRCA1 توسط پتنتهایی تحت مالکیت یا کنترل میریاد جنتیکس بود.[۴۱][۴۲] مدل کسبوکار میریاد جنتیکس که بهطور انحصاری آزمایش تشخیصی را ارائه میکرد، از آغاز کار آن به عنوان یک استارتآپ در سال ۱۹۹۴، منجر به تبدیل شدنش به یک شرکت سهامی عام با ۱۲۰۰ کارمند و حدود ۵۰۰ میلیون دلار درآمد سالانه در سال ۲۰۱۲ شد.[۴۳] اما در عین حال این موضوع موجب بحث و جدلهایی دربارهٔ قیمت زیاد این آزمایشها و همچنین عدم امکان تأیید نتایج توسط آزمایشگاههای تشخیصی مستقل دیگر شد که به نوبه خود منجر به شکایت «انجمن آسیبشناسی مولکولی» علیه میریاد جنتیکس شد.[۴۴]
تمام جهشهای BRCA2 در سلولهای زایا که تا به امروز شناسایی شدهاند، ارثی بودهاند که احتمال یک اثر بنیانگذار قابل توجه را نشان میدهد که در آن یک جهش خاص در یک گروه جمعیتی کاملاً تعریفشده مشترک است و در تئوری میتوان آن را تا یک نیای مشترک ردیابی کرد. با توجه به پیچیدگی غربالگری این تغییرات ژنی، این جهشهای مشترک ارثی ممکن است روشهای مورد نیاز برای غربالگری جهش در جمعیتهای خاص را سادهتر کنند. تجزیه و تحلیل جهشهایی که با تواتر بالا رخ میدهند نیز امکان مطالعه بیان بالینی آنها را فراهم میکند.[۴۵] نمونه بارز اثر بنیانگذار در ایسلند یافت میشود، جایی که یک جهش BRCA2 (از نوع 999del5) تقریباً در همه خانوادههای سرطان پستان/تخمدان دیده میشود.[۴۶][۴۷] این جهش دگرقالب منجر به یک محصول پروتئینی بسیار کوتاه میشود. در یک مطالعه بزرگ که صدها نفر از افراد سرطانی و افراد کنترل را مورد بررسی قرار داد، این جهش 999del5 در ۰٫۶٪ از جمعیت عمومی یافت شد. شایان ذکر است، در حالی که ۷۲ درصد از بیمارانی که اثبات شد حامل این جهش خاص هستند، سابقه خانوادگی متوسط یا قوی سرطان پستان داشتند، اما ۲۸ درصد سابقه خانوادگی کمی از سرطان داشتند یا اصلاً سابقه خانوادگی نداشتند. این یافته بهشدت نمایانگر وجود ژنهای اصلاحکنندهٔ دیگری است که بر بیان فنوتیپی این جهش یا احتمالاً برهمکنش جهش BRCA2 با عوامل محیطی تأثیر میگذارند. نمونههای دیگری از جهشهای پایهگذار در ژن BRCA2 در جدول زیر آورده شده است.
| جمعیت یا زیرگروههای قومی | جهشهای BRCA2[۴۵][۴۸] | منابع |
|---|---|---|
| یهودیان اشکنازی | 6174delT | [۴۹] |
| هلندیها | 5579insA | [۵۰] |
| فنلاندیها | 8555T>G, 999del5, IVS23-2A>G | [۵۱][۵۲] |
| کاناداییهای فرانسویتبار | 8765delAG, 3398delAAAAG | [۵۳][۵۴][۵۵] |
| مجارها | 9326insA | [۵۶] |
| ایسلندیها | 999del5 | [۴۶][۴۷] |
| ایتالیاییها | 8765delAG | [۵۷] |
| اهالی ایرلند شمالی | 6503delTT | [۵۸] |
| پاکستانیها | 3337C>T | [۵۹] |
| اسکاتلندیها | 6503delTT | [۵۸] |
| اهالی اسلوونی | IVS16-2A>G | [۶۰] |
| اسپانیاییها | 3034delAAAC(کودون 936), 9254del5 | [۶۱] |
| سوئدیها | 4486delG | [۶۲] |
در گیاه آرابیدوپسیس تالیانا، از دست دادن همولوگ AtBRCA2 پروتئین BRCA2 باعث نقص شدید هم در میوز جنس نر و هم اختلال در رشد گامتوسیت ماده میشود.[۶۳] وجودِ پروتئین AtBRCA2 برای تخصیص موضعی مناسب کمپلکس سیناپتونمی پروتئین AtZYP1 و آنزیمهای ریکامبیناز AtRAD51 و AtDMC1 مورد نیاز است. علاوه بر این، AtBRCA2 برای اتصال میوزی فراخور مورد نیاز است؛ بنابراین AtBRCA2 احتمالاً برای ترمیم دیانای به شیوهٔ نوترکیبی همساخت مهم است. به نظر میرسد که AtBRCA2 برای کنترل مراحل یورش تکرشتهای با واسطه آنزیمهای AtRAD51 و AtDMC1 که جهت آسیبهای ترمیم دیانای در جریان میوز رخ میدهد، دخالت دارد.[۶۳]
همساختهای BRCA2 همچنین برای میوز در قارچ سیاهک ذرت،[۶۴] کرم الگانس[۶۵][۶۶] و مگس سرکه[۶۷] ضروری هستند.
موشهایی که نسخههای کوتاه شده و معیوب پروتئین BRCA2 را تولید میکنند، زنده اما عقیم میمانند.[۶۸] به عبارت دیگر موشهای دچار جهش BRCA2 دارای فنوتیپ توقف رشد و عقیمی در هر دو جنس هستند.[۶۹] اختلال در تولید اسپرم در این موشهای جهشیافته به دلیل شکست اتصال کروموزوم همولوگ در جریان میوز سلولی است.
آنزیم DMC1 (دیانای میوز ریکامبیناز ۱) یک همولوگ اختصاصی میوز از آنزیم RAD51 است که تبادل رشته در طول ترمیم به شیوهٔ نوترکیبی همساخت را میانجیگری میکند. این آنزیم در واقع تشکیل محصولات «یورش رشتهای» به دیانای (مولکولهای اتصالی) بین مولکولهای DNA همولوگ را افزایش میدهد. این آنزیم در انسان مستقیماً با هر یک از سری توالی تکرارشونده در پروتئین BRCA2 (موسم به تکرارهای بیآرسی) که تشکیل مولکولهای اتصالی توسط DMC1 را تحریک میکند، تعامل دارد.[۷۰] تکرارهای بیآرسی منطبق با یک موتیف ساختاری متشکل از یک توالی از حدود ۳۵ اسید آمینه بسیار حفاظتشده است که دستکم یک بار در همه پروتئینهای شبه BRCA2 دیده میشود. توالی بیآرسی در BRCA2 تشکیل مولکولهای اتصالی را با افزایش تعامل دیانای تکرشتهای با DMC1 تحریک میکند.[۷۰] دیانای تکرشتهای ترکیب شده شده با آنزیم DMC1 میتواند با یک دیانای تکرشتهای همولوگ از کروموزومی دیگر در مرحله خلاصه میوز جفت شود تا یک مولکول مشترک را تشکیل دهد که مرحلهای اساسی در نوترکیبی همساخت است؛ بنابراین به نظر میرسد توالیهای تکرارشوندهٔ بیآرسی در BRCA2 نقش کلیدی در ترمیم آسیبهای دیانای در جریان نوترکیبی میوزی ایفا میکنند.
این پروتئین در موش برای عصبزایی و جلوگیری از مدولوبلاستوما مورد نیاز است.[۷۱] از دست دادن ژن BRCA2 عمیقاً بر عصبزایی تأثیر میگذارد، به ویژه در طول رشد عصبی جنینی و پس از تولد. این نقایص عصبی از آسیب دیانای ناشی میشوند.[۷۱]
تغییرات اپیژنتیکی در بیان ژن BRCA2 (که باعث بیان بیش از حد یا کمبیانی ژن میشود) در سرطانهای غیر ارثی بسیار شایع است (جدول زیر را ببینید) در حالی که به ندرت میتوان جهش در BRCA2 را در فرد مبتلا یافت میشود.[۷۲][۷۳][۷۴]
این ژن در سرطان ریه از نوع سلول غیر کوچک، بهطور اپیژنیک توسط هیپرمتیلاسیون پروموتر سرکوب میشود.[۷۵] در این مورد، هیپرمتیلاسیون پروموتر بهطور قابل توجهی با بیان کم آرانای پیامرسان و یاخت اندک پروتئین ارتباط دارد، اما با از دست دادن هتروزیگوسیتی ژن مرتبط نیست.
در موارد غیر ارثی سرطان تخمدان اثری معکوس مشاهده میشود. پروموتر BRCA2 و نواحی رمزخوانینشدهٔ ۵ پرایم، تعداد نسبتاً کم یا حتی فاقد دینوکلئوتیدهای متیلهشدهٔ CpG در دیانای تومور در مقایسه با دیانای سلولهای سالم هستند، و ارتباط قابل توجهی بین هیپومتیلاسیون و بیان بیش از ۳ برابری ژن BRCA2 یافت میشود.[۷۶] این موضوع نشان میدهد که هیپومتیلاسیون پروموتر BRCA2 و نواحی رمزخوانینشدهٔ ۵ پرایم منجر به بیان بیش از حد آرانای پیامرسان این ژن میشود.
یک گزارش پژوهشی نشان داد که بیان ژن BRCA2 توسط ریزآرانایهای miR-146a و miR-148a کنترل اپیژنیک دارد.[۷۷]
در یوکاریوتها، پروتئین BRCA2 نقش مهمی در ترمیم نوترکیبی همساخت دارد. در موشها و انسانها، BRCA2 اساساً همگذاری منظم RAD51 را بر روی دیانای تکرشتهای میانجیگری میکند، شکلی از مولکول که برای جفت شدن همولوگ و یورش به رشتههای دیانای فعال است.[۷۸] BRCA2 همچنین آنزیم RAD51 را از دیانای دو رشتهای تغییر مسیر میدهد و گاهی هم از جدا شدنش از دیانای دو رشتهای جلوگیری میکند.[۷۸] علاوه بر این، چهار پارالوگ آنزیم RAD51، متشکل از RAD51L1، RAD51L2، RAD51L3 و XRCC2 مجموعهای به نام «کمپلکس BCDX2» را تشکیل میدهند (شکل ترمیم نوترکیبی همساخت دیانای را ببینید). این مجموعه در بهخدمتگیری RAD51 یا تثبیت محلهای آسیب دخالت دارد.[۲۵] به نظر میرسد کمپلکس BCDX2 از طریق تسهیل همگذاری یا پایدار کردن رشته نوکلئوپروتئین RAD51 عمل میکند. آنزیم RAD51 انتقال رشته را بین یک توالی شکسته و همولوگ سالم آن تسهیل میکند تا امکان ساخت و ترمیم مجدد ناحیه آسیب دیده را فراهم کند (به مدلهای نوترکیبی همساخت مراجعه کنید).
برخی از مطالعات انجام شده بر روی سرطانها بیان بیش از حدِ ژن BRCA2 را گزارش میکنند در حالی که مطالعات دیگر بیان ناکافی آن را را گزارش کردهاند. دستکم دو گزارش بیان بیش از حد را در برخی از تومورهای غیر ارثی پستان و کمبیانی آن را در سایر تومورهای غیر ارثی پستان نشان دادند.[۷۹][۸۰] (جدول را ببینید).
بسیاری از سرطانها دارای نقص اپیژنتیکی در ژنهای مختلف ترمیم دیانای هستند (به فراوانی اپی موتاسیونها در ژنهای ترمیم دیانای در سرطانها مراجعه کنید). این نقص ترمیم احتمالاً باعث انباشت آسیبهای دیانای ترمیم نشده میشود. بیان بیش از حد BRCA2 که در بسیاری از سرطانها دیده میشود ممکن است منعکس کننده بیان جبرانی BRCA2 و افزایش ترمیم نوترکیبی همساخت باشد تا حداقل تا حدی با چنین آسیبهای اضافی دیانای مقابله کند. اِگاوا و همکاران نشان دادند که افزایش بیان BRCA2 را میتوان با بیثباتی ژنومی که اغلب در سرطانها مشاهده میشود، توضیح داد[۸۱] که بیان آرانای پیامرسان ژن BRCA2 را بهدلیل افزایش نیاز به پروتئین BRCA2 برای ترمیم دیانای تشدید میکند.
بیان ناکافی ژن BRCA2 خود منجر به انباشت آسیبهای دیانای ترمیم نشده میشود. خطاهای تکراری گذشته از این آسیبها (به سنتز ترانسلیون مراجعه کنید) منجر به افزایش جهش ژنی و بروز سرطان میشود.
| سرطان | میزان بیان ژن | میزان تغییر در بیان ژنی | روش ارزیابی | منبع. |
|---|---|---|---|---|
| سرطان تخمدان غیر ارثی | بیان بیش از حد | ۸۰٪ | آرانای پیامرسان | [۷۶] |
| سرطان تخمدان غیر ارثی | کمبیانی | ۴۲٪ | ایمونوهیستوشیمی | [۸۲] |
| (سرطانهای عودکننده/راجعه در مطالعه فوق) | افزایش بیان ژن | ۷۱٪ | ایمونوهیستوشیمی | [۸۲] |
| سرطان ریه از نوع سلول غیر کوچک | کمبیانی | ۳۴٪ | ایمونوهیستوشیمی | [۷۵] |
| سرطان پستان | بیان بیش از حد | ۶۶٪ | آرانای پیامرسان | [۸۱] |
| سرطان پستان | بیان بیش از حد | ۲۰٪ | آرانای پیامرسان | [۷۹] |
| (مشابه مطالعهٔ فوق) | کمبیانی | ۱۱٪ | آرانای پیامرسان | [۷۹] |
| سرطان پستان | بیان بیش از حد | ۳۰٪ | ایمونوهیستوشیمی | [۸۰] |
| (مشابه مطالعهٔ فوق) | کمبیانی | ۳۰٪ | ایمونوهیستوشیمی | [۸۰] |
| سرطان پستان سهگانه-منفی | کمبیانی | ۹۰٪ | ایمونوهیستوشیمی | [۸۳] |
پروتئین BRCA2 با مولکولای زیر تعامل پروتئین-پروتئین دارد:
| BRCA2 repeat | |||||||||
|---|---|---|---|---|---|---|---|---|---|
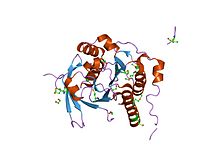 ساختار کریستالی یک کمپلکس توالی بیآرسی rad51-brca2 | |||||||||
| شناسهها | |||||||||
| نماد | BRCA2 | ||||||||
| پیفم | PF00634 | ||||||||
| اینترپرو | IPR002093 | ||||||||
| SCOPe | 1n0w / SUPFAM | ||||||||
| |||||||||
پروتئین BRCA2 حاوی تعداد ۳۹ تکرار اسید آمینه است که برای اتصال به آنزیم RAD51 (پروتئین کلیدی در ترمیم نوترکیبی همساخت دیانای) و مقاومت در برابر درمان متیل متانسولفونات حیاتی هستند.[۱۰۰][۱۰۷][۱۰۸][۱۱۶]
دومِـین مارپیچ BRCA2 ساختاری پیچهای دارد که از یک هسته خوشهای چهار مارپیچ (آلفا ۱، آلفا ۸، آلفا ۹، آلفا ۱۰) و دو ساختار گیرهای شکل بتا (بتا ۱ تا بتا ۴) تشکیل شده است. یک بخش تقریباً ۵۰ اسید آمینهای که شامل چهار مارپیچ کوتاه (آلفا ۲ تا آلفا ۴) است، در اطراف سطح ساختار مرکزی پیچ و تاب میخورد. در پروتئین BRCA2، مارپیچهای آلفا ۹ و آلفا ۱۰ با دومِـین OB1 آن از طریق نیروی واندروالسی پیوند میخورد و شامل ریشهٔ آبگریز و آروماتیک و همچنین از طریق زنجیر جانبی و ستون اصلی و مستحکم پیوندهای هیدروژنی احاطه میشوند. این دومِـین به پروتئین ۷۰ آمینو اسیدی DSS1 (حذف شده در سندرم شکاف دست/شکاف پا) متصل میشود، که در ابتدا به عنوان یکی از سه ژنی شناسایی شد که به یک حذف ژنتیکی جایگاه کروموزومی ۱٫۵ میلیون بازی در یک سندرم ارثی ناهنجاری رشدی ارثی نسبت داده میشود.[۱۱۴]
دومِـین OB1 این ژن شکل یک چین OB را به خود میگیرد که از یک صفحه بتای پنج رشتهای بسیار خمیده تشکیل شده است که روی خود تا میخورد تا ساختاری به نام بشکه بتا ایجاد کند. OB1 دارای یک شیار کم عمق است که توسط یک وجه از صفحهٔ انحنایافته تشکیل شده است و توسط دو حلقه مرزبندی میشود، یکی بین بتا ۱ و بتا ۲ و دیگری بین بتا ۴ و بتا ۵، که امکان اتصال ضعیف دیانای تکرشتهای را فراهم میکند. این دومِـین همچنین به پروتئین ۷۰-آمینو اسیدی DSS1 (حذف شده در سندرم شکاف دست/شکاف پا) متصل میشود.[۱۱۴]
دومِـین BRCA این ژن نیز شکل یک چین OB را به خود میگیرد که از یک صفحه صفحه بتای پنج رشتهای بسیار خمیده تشکیل شده است که روی خود تا میشود تا یک بشکه بتا را تشکیل دهد. OB3 دارای یک شیار برجسته است که توسط یک وجه از صفحهٔ انحنایافته تشکیل شده است و توسط دو حلقه مرزبندی میشود، یکی بین بتا ۱ و بتا ۲ و دیگری بین بتا ۴ و بتا ۵، که امکان اتصال قوی دیانای دورشتهای را فراهم میکند.[۱۱۴]
دومِـین تاوِر (برجمانند) ساختار ثانویهای متشکل از یک جفت مارپیچ آلفای بلند و غیر موازی (ساقه) دارد که از یک کلاف سه مارپیچی (3HB) در انتهای خود حمایت میکند. 3HB حاوی یک موتیف ساختاری مارپیچ-پیچ-مارپیچ است و شبیه به دومِـینهای متصلشونده به دیانای از ریکامبیناز مکانمحور باکتریها و همچنین فاکتورهای رونویسی یوکاریوتی MYB و هومئوباکس است. دومِـین تاوِر نقش مهمی در عملکرد سرکوبگر تومور توسط این پروتئین BRCA2 دارد و برای اتصال مناسب این پروتئین به دیانای ضروری است.[۱۱۴] مطالعات نشان داد که ترکیب این دومِـین تاوِر به صورت آلوستریک توسط پروتئین کوچک "DSS1" کنترل میشود که با دومِـینهای مارپیچ، OB1 و OB2 در پروتئین BRCA2 تعامل شیمیایی دارد.[۱۱۷]
یک درخواست ثبت اختراع برای ژن جداشده BRCA1 و جهشهای محرک سرطان و همچنین روشهایی برای تشخیص احتمال ابتلا به سرطان پستان، توسط دانشگاه یوتا، مؤسسه ملی علوم بهداشت محیط (NIEHS) و میریاد جنتیکس در سال ۱۹۹۴ ثبت شد.[۴۱] طی سال آتی، میریاد جنتیکس با همکاری سایر پژوهشگران، ژن BRCA2 را جداسازی و توالییابی کرد و جهشهای مربوط را شناسایی کرد و نخستین ثبت اختراع BRCA2 توسط میریاد و سایر موسسات در سال ۱۹۹۵ در ایالات متحده ثبت شد.[۴۰] میریاد دارنده مجوز انحصاری این ثبت اختراعهاست و آنها را بهشدت در ایالات متحده آمریکا در برابر آزمایشگاههای تشخیص بالینی اجرا کرده است.[۴۴] این مدل کسبوکار باعث شد تا میریاد از یک استارتآپ ساده در سال ۱۹۹۴ به یک شرکت سهامی عام با ۱۲۰۰ کارمند و حدود ۵۰۰ میلیون دلار درآمد سالانه در سال ۲۰۱۲ مبدل شود؛[۴۳] همچنین منجر به بحثهایی در مورد قیمتهای بالا آزمایشهای ژنتیکی و ناتوانی بیمار در دریافت نظر ثانویه از دیگران و تأیید آزمایشهای اولیه (از طریق انجام آزمایشهای مشابه در مکانهای دیگر) شد. آزمایشگاههای تشخیصی، که به نوبه خود منجر به شکایت انجمن آسیبشناسی مولکولی در برابر میریاد جنتیکس شد.[۴۴][۱۱۸] انقضای این ثبت اختراعها از سال ۲۰۱۴ آغاز شد.
پیتر ملدروم، مدیر اجرایی میریاد جنتیکس، اذعان کرده است که میریاد جنتیکس در اروپا «مزایای رقابتی دیگری دارد که ممکن است اجرای چنین [ثبت اختراعی] را غیرضروری کند.»[۱۱۹]
تصمیمات قانونی پیرامون ثبت اختراع زیستشناختی BRCA1 و BRCA2 بر حوزه آزمایش ژنتیک بهطور کلی تأثیر میگذارد.[۱۲۰] در ژوئن ۲۰۱۳، طی شکایت انجمن آسیبشناسی مولکولی علیه میریاد جنتیکس (شماره ۱۲–۳۹۸)، دیوان عالی ایالات متحده آمریکا به اتفاق آرا حکم داد که «یک قطعه دیانای بهطور طبیعی محصولی از طبیعت است و صرفاً به این دلیل که جدا شده است واجد شرایط ثبت اختراع نیست» و ثبت اختراع میریاد جنتیکس در مورد ژنهای BRCA1 و BRCA2 را باطل کرد. با این حال، دادگاه همچنین اعلام کرد که دستکاری یک ژن برای ایجاد چیزی که در طبیعت یافت نمیشود همچنان میتواند برای حمایت از حق ثبت اختراع واجد شرایط باشد.[۱۲۱] دادگاه فدرال استرالیا در فوریه ۲۰۱۳ به نتیجه معکوس رسید و حق ثبت اختراع میریاد جنتیکس در استرالیا برای ژن BRCA1 را در فوریه ۲۰۱۳ تأیید کرد،[۱۲۲] اما این تصمیم در حال تجدیدنظرخواهی است و درخواست تجدیدنظر شامل رسیدگی به حکم دادگاه عالی ایالات متحده خواهد بود.[۱۲۳]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.