ترکیب شیمیایی با فرمول CO₂ From Wikipedia, the free encyclopedia
کربن دیاکسید یا دیاکسید کربن (با فرمول شیمیایی CO۲)، از ترکیب کربُن با اکسیژن به دست میآید. گاز کربنیک (به فرانسوی: gaz carbonique) بر اثر سوختن زغال و مواد آلی در مجاورت اکسیژن، تخمیر مایعات، تنفس جانوران و گیاهان و غیره به دست میآید. به سخن سادهتر، اگر سوختن کامل صورت گیرد، گاز کربنیک تولید میشود. تعداد پیوندهای کووالانسی در آن ۴ است و دو قلمرو الکترونی دارد.
| کربن دیاکسید | |||
|---|---|---|---|
| |||
کربن دیاکسید | |||
دیگر نامها گاز کربنیک؛ گاز کربنیک اسید؛ انیدرید کربنیک؛ یخ خشک (جامد) | |||
| شناساگرها | |||
| شماره ثبت سیایاس | ۱۲۴-۳۸-۹ | ||
| پابکم | ۲۸۰ | ||
| شمارهٔ ئیسی | 204-696-9 | ||
| شمارهٔ یواِن | 1013 جامد (یخ خشک): 1845 مخلوط با اتیلن اکساید: 1952 3300 | ||
| شمارهٔ آرتیئیسیاس | FF6400000 | ||
| جیمول-تصاویر سه بعدی | Image 1 | ||
| |||
| |||
| خصوصیات | |||
| فرمول مولکولی | CO2 | ||
| جرم مولی | 44.0095(14) g/mol | ||
| شکل ظاهری | colorless gas | ||
| چگالی | 1600 g/L solid; 1.98 g/L gas | ||
| دمای ذوب | −۷۸ °C (195 K) (تحت فشار) | ||
| دمای جوش | −۵۷ °C (216 K), (تصعید) | ||
| انحلالپذیری در آب | 1.45 g/L | ||
| اسیدی (pKa) | 6.35 and 10.33 | ||
| گرانروی | 0.07 cP at -78 °C | ||
| گشتاور دوقطبی | صفر | ||
| ساختار | |||
| شکل مولکولی | خطی | ||
| ترکیبات مرتبط | |||
| مرتبط با اکسیدها | منوکسید کربن؛ کربن سابوکسید; منوکسید دی کربن؛ کربن تریاکسید | ||
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |||
| Infobox references | |||
|
| |||
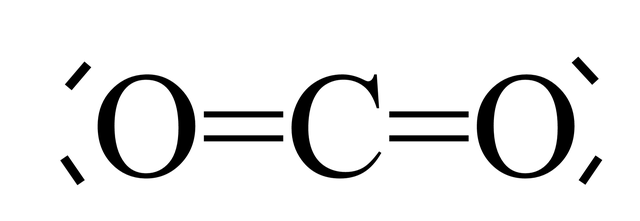
گاز کربنیک گازی بیرنگ، بیبو، دارای طعمی مایل به اسید و دارای وزن مخصوص ۱/۵۲ است. این گاز سنگینتر از هواست و معمولا در کف محیط یا ظرف قرار می گیرد. (این گاز۰/۰۳٪ از هوا را تشکیل میدهد)
گیاهان از آن در فرایند فتوسنتز برای فرآوری کربوهیدراتها بهره میبرند و با گرفتن آن، از خود اکسیژن بیرون میدهند. CO۲ حاضر در اتمسفر در نقش یک سپر حرارتی برای زمین کار میکند و با اثر گلخانهای طبیعی خود، از سرما در زمین جلوگیری میکند. اگرچه تراکمهای بالای کربن دیاکسید در جو زمین، که با سوختن سوختهای فسیلی تولید میشود، به عنوان آلاینده جوی شناخته میشود.
گازهای گلخانهای که کربن دیاکسید نیز یکی از آنهاست باعث میشود که اشعههای خورشید با طول موج پایین و از ابرها که آنها نیز جز گازهای گلخانهای هستند بگذرند و بعد از برخورد به سطح زمین بازتاب شده و طول موج آن افزایش مییابد و از پرتوهای فرابنفش به فروسرخ تبدیل میگردد. پرتوهای فروسرخ خطرناک نیستند و بعد از برخورد به گازهای گلخانهای بازمیگردند و نمیتوانند از آنجا عبور کنند و باعث گرم شدن میشوند.
در صورت تنفس این گاز انسان ابتدا احساس تنگی نفس کرده و پس از مدت بسیار طولانی ممکن است خفه شود. کربن دیاکسید برخلاف اکسیژن که باعث شعلهور تر شدن آتش میشود، باعث خفگی آتش میشود، به همین خاطر است که در کپسولهای آتشنشانی گاز کربن دیاکسید وجود دارد.
بهطور طبیعی در جو زمین به عنوان گاز ردیابی در غلظت حدود ۰٫۰۴ درصد (400 ppm) در حجم اتفاق میافتد. منابع طبیعی شامل آتشفشان، چشمههای آب گرم و گیزرها هستند و از طریق انحلال در آب و اسیدها از سنگهای کربنات آزاد میشوند. از آنجا که کربن دیاکسید محلول در آب است، بهطور طبیعی در آبهای زیرزمینی، رودخانهها و دریاچهها، یخ پوشیده شده، یخچالها و آب دریا رخ میدهد. این موجود در ذخایر نفت و گاز طبیعی است. کربن دیاکسید در غلظتهای معمول مواجهه بیبو است، با این حال در غلظتهای بالا بوی تند و اسیدی است.
به عنوان منبع کربن موجود در چرخه کربن، کربن دیاکسید جوی منبع اصلی کربن برای زندگی در زمین است و غلظت آن در فضای صنعتی قبل از صنعت زمین از زمان دیر شدن پرکامبرین توسط موجودات فتوسنتز و پدیدههای زمینشناسی تنظیم شدهاست. گیاهان، جلبکها و سیانوباکتریها از انرژی نور برای فتوسنتز کربوهیدرات از کربن دیاکسید و آب استفاده میکنند، با اکسیژن به عنوان یک ماده زباله تولید میشود.
کربن دیاکسید (CO۲) توسط تمام موجودات هوازی تولید میشود زمانی که آنها متابولیزه کربوهیدرات و چربی برای تولید انرژی توسط تنفس. از طریق غرقابی ماهی و به هوا از طریق ریههای جانوران سرزنده هوا تنفس، از جمله انسان، به آب منتقل میشود. کربن دیاکسید در طول فرایند فروپاشی مواد آلی و تخمیر قند در نان، آبجو و آبزی تولید میشود. این تولید توسط احتراق چوب و دیگر مواد آلی و سوختهای فسیلی مانند زغالسنگ، نفت و گاز طبیعی تولید میشود. از سوی دیگر، در بسیاری از فرایندهای اکسیداسیون در مقیاس بزرگ، به عنوان محصول جانبی ناخواسته، به عنوان مثال تولید اسید اکریلیک (بیش از ۵ میلیون تن در سال) است.
این یک ماده صنعتی چند منظوره است که برای مثال، به عنوان یک گاز غیرمستقیم در جوشکاری و آتش خاموش، به عنوان یک گاز فشار در اسلحه هوایی و بازیابی نفت، به عنوان یک ماده شیمیایی و در فرم مایع به عنوان یک حلال در کافئین قهوه و فوق بحرانی خشک کردن. این افزودنی به آب آشامیدنی و نوشابههای گازدار شامل آبجو و شرابهای گازدار نیز اضافه میشود. شکل جامد یخ زده از CO۲، به نام یخ خشک شناخته شده به عنوان یک مبرد و به عنوان ساینده در انفجار خشک یخ استفاده میشود.
کربن دیاکسید مهمترین گازهای گلخانهای طولانی مدت در جو زمین است. از آنجایی که انتشارات انسانشناسی انقلاب صنعتی، عمدتاً از استفاده از سوختهای فسیلی و جنگلزدایی، غلظت آن در جو به سرعت در حال افزایش است و منجر به گرم شدن کره زمین میشود. CO۲ که در نتیجه استفاده از سوختهای فسیلی به اتمسفر وارد شدهاست "نشان دهنده [۴/۹۹ درصد از انتشار گازهای گلخانهای در سال ۲۰۱۳]" است. کربن دیاکسید همچنین باعث اسیدی شدن اقیانوسها میشود، زیرا در آب برای تشکیل اسید کربنیک حل میشود.
کربن دیاکسید اولین گاز است که به عنوان یک ماده گسسته توصیف میشود. در حدود ۱۶۴۰ شیمیدانی به نام ژان باپتیست ون هلمونت مشاهده کرد که هنگامی که زغال چوب را در یک ردیف بسته سوزاند، توده خاکستر حاصل از آن بسیار کمتر از زغال چوب اصلی بود. تفسیر او این بود که بقیه زغال چوب به یک ماده نامرئی تبدیل شده که به معنای گاز یا روح وحشی بود. کربن دیاکسید اولین بار در سال ۱۸۲۳ توسط همفری دیوی و مایکل فارادی تحت فشار بالا مایع شد. اولین توصیف کربن دیاکسید جامد توسط تیلوئییِر، که در سال ۱۸۳۵ یک کانتینر تحت فشار کربن دیاکسید مایع را باز کرد، تنها به این نتیجه رسید که خنککننده تولید شده توسط تبخیر سریع مایع، «برف» جامد بودهاست.
مولکول کربن دیاکسید خطی و مرکزی است. طول پیوند کربن-اکسیژن ۱۱/۳۶pm است که بهطور قابل توجهی کوتاهتر از طول اتصال پیوند تک باند C-O است و حتی کوتاهتر از بسیاری از گروههای دیگر C-O چند ضلعی است. از آنجایی که آن centrosymmetric است، مولکول دارای دو قطبی الکتریکی نیست. در نتیجه، تنها دو موج ارتعاشی در طیف IR مشاهده میشود - یک حالت کشش ناقص در 2349 cm-۱ و یک جفت ناپایدار از حالت خمش در 667 cm-۱. همچنین یک حالت کشش متقارن در 1388 cm-۱ وجود دارد که تنها در طیف رامان دیده میشود.
کربن دیاکسید محلول در آب است که H2CO۳ (اسید کربنیک) که یک اسید ضعیف است از زمان یونیزاسیون آن در آب به صورت ناقص به وجود میآید.
CO2+H2O⇌H2CO3
هدف اصلی ایجاد مخازن ذخیره دیاکسید کربن، کاهش انتشار گازهای گلخانهای به جو و مقابله با تغییرات آب و هوا است. با ذخیره CO2 در مخازن، این گازهای گلخانهای از ورود به جوی زمین جلوگیری میشود و احتمال تأثیرات منفی آنها بر آب، خاک و هوا به حداقل ممکن میرسد.
مخزن co2 یا مخزن ذخیره دی اکسید کربن مایع را می توان به مخزن عایق فوم پلی اورتان و مخزن آدیاباتیک پودر خلاء با دمای کار منهای 40 درجه طبقه بندی کرد، ماده اصلی آن می تواند OCrI8nI9 یا 16 MnDR باشد.
CO۲ یک الکترون دوست (الکتروفیل) ضعیف است. واکنش آن با آب پایه این ویژگی را نشان میدهد، در این صورت هیدروکسید نوکلئوفیلی است. دیگر اسیدهای نوکلئوفیل نیز واکنش نشان میدهند. به عنوان مثال، کاربنیونها (یون منفی و گذرا مانند H3C) به وسیله واکنش گرینجر (واکنشگر) و ترکیبات ارگانولیتیم با واکنشهای CO۲ واکنش نشان میدهند:
MR + CO۲ → RCO۲M
در ترکیبات کربن دیاکسید فلز، CO۲ به عنوان یک لیگاند عمل میکند که میتواند تبدیل CO۲ به سایر مواد شیمیایی را آسان کند.
کاهش CO۲ به CO معمولاً یک واکنش دشوار و آهسته است: CO2 + 2 e− + ۲H+ → CO + H۲O
کربن دیاکسید بیرنگ است. در غلظتهای پایین گاز بدون بو است، با این حال، در غلظتهای بسیار بالایی، آن دارای بوی تند و اسیدی است. در دمای و فشار استاندارد، کربن دیاکسید حدود ۱٫۹۸ کیلوگرم در متر مکعب است که حدود ۱٫۶۷ برابر هوا است. کربن دیاکسید به هیچ عنوان حالت مایع را در فشار کمتر از ۵٫۱ اتمسفر (۵۲۰ kPa) ندارد. در اتمسفر ۱ (در نزدیکی فشار متوسط سطح دریا)، گاز بهطور مستقیم به یک جامد در دمای زیر ۷۸٫۵- درجه سانتیگراد (۱۰۹٫۳- درجه فارنهایت؛ ۱۹۴/۷ K) قرار میگیرد و ذرات جامد بهطور مستقیم به گاز بالاتر از ۷۸٫۵- درجه سانتی گراد تبدیل میشود (تصعید). در حالت جامد، کربن دیاکسید یخ خشک نامیده میشود. کربن دیاکسید مایع فقط در فشار بیش از ۵٫۱ اتمسفر تشکیل میگردد؛ نقطه سهگانه کربن دیاکسید حدود ۵٫۶۹ بار (۵۱۷ کیلو پاسکال) در ۲۱۷ K است (نمودار فاز را در سمت چپ ببینید). نقطه بحرانی ۷/۳۸ مگاپاسکال در ۳۱٫۱ درجه سانتیگراد است. شکل دیگری از کربن دیاکسید جامد که در فشار بالا دیده میشود یک جامد شبیه به آمورف است. این شکل شیشهای که کربنات نامیده میشود، به وسیلهٔ فشار بیش از حد بر فشار گاز (۴۰–۴۸ GPa یا حدود ۴۰۰٬۰۰۰ اتمسفر) در یک الماس تولید میشود. این کشف تأیید کرد که کربن دیاکسید میتواند در حالت شیشهای مشابه سایر اعضای خانواده عنصری مانند سیلیکون (شیشه سیلیکا) و دیاکسید گرسنه وجود داشته باشد. با این حال، برخلاف عینک سیلیکا و آلمانی، شیشه کربنی در فشارهای معمول پایدار نیست و هنگامی که فشار آزاد میشود، به گاز بازگردد.
در دمای و فشارهای بالاتر از نقطه بحرانی، کربن دیاکسید به عنوان یک ماده فوق بحرانی شناخته شده به عنوان کربن دیاکسید فوق بحرانی عمل میکند.

بخار آب، کربن دیاکسید، متان و ازن مؤثرترین گازهای گلخانهای هستند. با وجودی که نمیتوان بهطور دقیق مشخص کرد که سهم هر کدام از این گازها در اثر گلخانهای زمین چقدر است اما بخار آب بین ۳۶٪ تا ۷۰٪، کربن دیاکسید بین ۹٪ تا ۲۶٪، متان بین ۴٪ تا ۹٪ و ازن حدود ۳٪ تا ۷٪ در فرایند اثر گلخانهای زمین نقش بازی میکنند؛ یعنی بهطور کلی کربن دیاکسید بین گازهای گلخانهای ناشی از صنعت و کشاورزی بیشترین سهم را در خصوص پدیده گرمایش زمین دارد.[1][2]
افزایش سطح کربن دیاکسید در جو همچنین منجر به افزایش نرخ فتوسنتز میشود زیرا گیاهان دیگر نیاز به بازنگهداشتن روزنهٔ هواییشان برای مدّت طولانی ندارند تا کربن دیاکسید بیشتری را جذب کنند و نتیجهٔ آن استفادهٔ بیشتر از آب است.[3]

کربن دیاکسید توسط صنایع غذایی، صنعت نفت و صنایع شیمیایی استفاده میشود. نوع ترکیب این ترکیبات تجاری متنوع است، اما یکی از بزرگترین کاربرد آن به عنوان یک ماده شیمیایی در تولید نوشابههای گازدار است؛ این نوشیدنیها را در نوشابههای گازدار مانند آب سودا فراهم میکند.
در صنایع شیمیایی، کربن دیاکسید عمدتاً به عنوان یک ماده در تولید اوره مصرف میشود، با یک کسر کوچکتر که برای تولید متانول و طیف وسیعی از محصولات دیگر مانند کربناتهای فلزی و بیکربناتها استفاده میشود. مشتقات اسید کربوکسیلیک مانند سدیم سالیسیلات با استفاده از CO۲ توسط واکنش کلبه-شیمیت تهیه میشوند. علاوه بر فرایندهای متداول با استفاده از CO۲ برای تولید مواد شیمیایی، روشهای الکتروشیمیایی نیز در سطح تحقیق مورد بررسی قرار میگیرند. بهطور خاص، استفاده از انرژیهای تجدیدپذیر برای تولید سوخت از CO۲ (مانند متانول) جذاب است، زیرا این امر میتواند به سوختهایی تبدیل شود که میتوانند به راحتی حمل و استفاده شوند در تکنولوژیهای احتراق معمولی، اما بدون CO۲ این امر میسر نمیشود.
کربن دیاکسید یک افزودنی مواد غذایی است که به عنوان یک ماده رگولاتور پروانهای (محرک) و اسیدی در صنایع غذایی استفاده میشود. این مورد برای استفاده در اتحادیه اروپا (به عنوان شماره E۲۹۰ ذکر شده)، ایالات متحده و استرالیا و نیوزیلند (فهرست شده توسط INS شماره ۲۹۰) تأیید شده است. آب نبات به نام راک پاپ تحت فشار گاز کربن دیاکسید در حدود ۴ x 106 Pa (40 bar، 580 psi) تحت فشار قرار میگیرد. هنگامی که در دهان قرار میگیرد، آن را حل میکند (درست مانند دیگر آب نباتهای سخت) و حبابهای گاز را با پاپ قابل شنیدن آزاد میکند. علت ریزش مو میتوانند با تولید کربن دیاکسید توسط، خمیر را افزایش دهند. مخمر بیکر کربن دیاکسید را با تخمیر قند درون خمیر تولید میکند، در حالی که مواد شیمیایی مانند پودر پخت و نوشابه گازدار کربن دیاکسید در هنگام گرم شدن یا در معرض اسیدها قرار میگیرند.
کربن دیاکسید برای تولید نوشابههای گازدار و آب سودا استفاده میشود. بهطور سنتی، کربناته آبجو و شراب درخشان از طریق تخمیر طبیعی به دست آمد، اما بسیاری از تولیدکنندگان این نوشیدنیها را با کربن دیاکسید از فرایند تخمیر بهبود میدهند. در مورد آبجو بطری و آبجو، رایجترین روش کربناته کردن با کربن دیاکسید بازیافت است. به استثنای بریتانیا حقیقتاً، آبجو پیشنویس معمولاً از قفسهها در یک اتاق سرد یا انبار به شیپور خاموشی در نوار با استفاده از کربن دیاکسید تحت فشار، گاهی با نیتروژن مخلوط، منتقل میشود.
این یکی از رایجترین گازهای فشرده شده برای سیستمهای پنوماتیک (فشار گاز) در ابزار فشار قابل حمل است. کربن دیاکسید نیز در فضای جوشکاری مورد استفاده قرار میگیرد، اگرچه در جوشکاری، اکسیدهای اکثر فلزات را واکنش میدهد. با وجود شواهد قابل توجهی مبنی بر اینکه جوشهای ساخته شده در فضا کربن دیاکسید شکنندهتر از آنهایی است که در اتمسفرهای بدون اثر CO۲ ساخته شدهاند، استفاده از آن در صنعت خودرو شایع است. به عنوان یک گاز جوش بهطور عمده به این دلیل استفاده میشود که بسیار ارزانتر از گازهای غیرمستقیم مانند آرگون یا هلیوم است. [نیازمندیهای ارجاعی] وقتی که برای جوشکاری MIG استفاده میشود، استفاده از گاز کربن دیاکسید به عنوان MAG جوشکاری CO۲ در این دماهای بالا میتواند واکنش نشان دهد.
CO۲ تمایل دارد که یک گودال گرمتر از جوهای واقعاً بیاثر تولید کند، ویژگیهای جریان را بهبود میبخشد. اگر چه ممکن است این امر به دلیل واکنشهای جوی در محل گودال باشد. CO۲ معمولاً مخالف اثر مورد نظر در هنگام جوشکاری است، زیرا که تمایل به جارو کردن محل را دارد، اما ممکن است برای جوشکاری فولاد ملایم مشکل نباشد، زیرا نشت نهایی یک نگرانی عمده نیست.
کربن دیاکسید میتواند برای خاموش کردن شعلههای آتشسوزی محیط اطراف شعله با گاز استفاده شود. CO۲ به خودی خود واکنش نشان نمیدهد تا شعله را خاموش کند، اما شعله اکسیژن را با جابجایی آن کاهش میدهد. بعضی از آتش خاموشکنندهها، به ویژه برای آتشسوزیهای الکتریکی، دارای کربن دیاکسید مایع تحت فشار هستند. خاموشکنندههای کربن دیاکسید به خوبی در مایعهای مایکروویو و الکتریکی قابل اشتعال کار میکنند، اما نه در آتشسوزیهای قابل اشتعال، چرا که گرچه اکسیژن را حذف میکند، مواد سوزاننده را بهطور قابل توجهی خنک نمیکند و زمانی که کربن دیاکسید پراکنده باشد، آنها میتوانند در معرض اتمسفر اکسیژن باشند. مطلوبیت آنها در آتشسوزی در واقع این است که، برخلاف آب و سایر روشهای شیمیایی، کربن دیاکسید موجب اتصال کوتاه نمیشود، که سبب آسیب بیشتر به تجهیزات میشود. از آنجا که این یک گاز است، همچنین حجم زیادی از گاز را بهطور خودکار در اتاقهای زیربنایی IT آزاد میکند، جایی که ممکن است آتش به روشهای فوری بیشتری دسترسی پیدا کند، زیرا در پشت دربهای قفسه و در داخل موارد است. کربن دیاکسید به عنوان یک عامل خاموشکننده در سیستمهای حفاظت از آتش ثابت برای استفاده محلی از خطرات خاص و کل سیل یک فضای محافظت شده بهطور گستردهای مورد استفاده قرار میگیرد. استانداردهای بینالمللی سازمان دریایی نیز سیستمهای کربن دیاکسید را برای حفاظت در برابر نگهداری از کشتیها و اتاقهای موتور تشخیص میدهند. سیستمهای حفاظت آتشسوزی مبتنی بر کربن دیاکسید به چندین مرگ منجر شده است، زیرا میتواند خفگی را در غلظتهای بسیار بالایی ایجاد کند. در بررسی سیستمهای CO۲ مشخص شده است که ۵۱ حادثه بین سال ۱۹۷۵ و تاریخ گزارش (۲۰۰۰)، باعث مرگ ۷۲ نفر و ۱۴۵ صدمه شد.
در پزشکی، تا ۵٪ کربن دیاکسید (۱۳۰ بار غلظت جو) به اکسیژن برای تحریک تنفس پس از ایست موقتی تنفسی اضافه میشود و برای تثبیت تعادل در خون از O۲ / CO۲ کمک میگیرند. کربن دیاکسید میتواند با اکسیژن تا ۵۰٪ مخلوط شود، یک گاز قابل استنشاق ایجاد میشود؛ این به عنوان کاربوژن شناخته شده است و دارای انواع پزشکی و تحقیقاتی است.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.