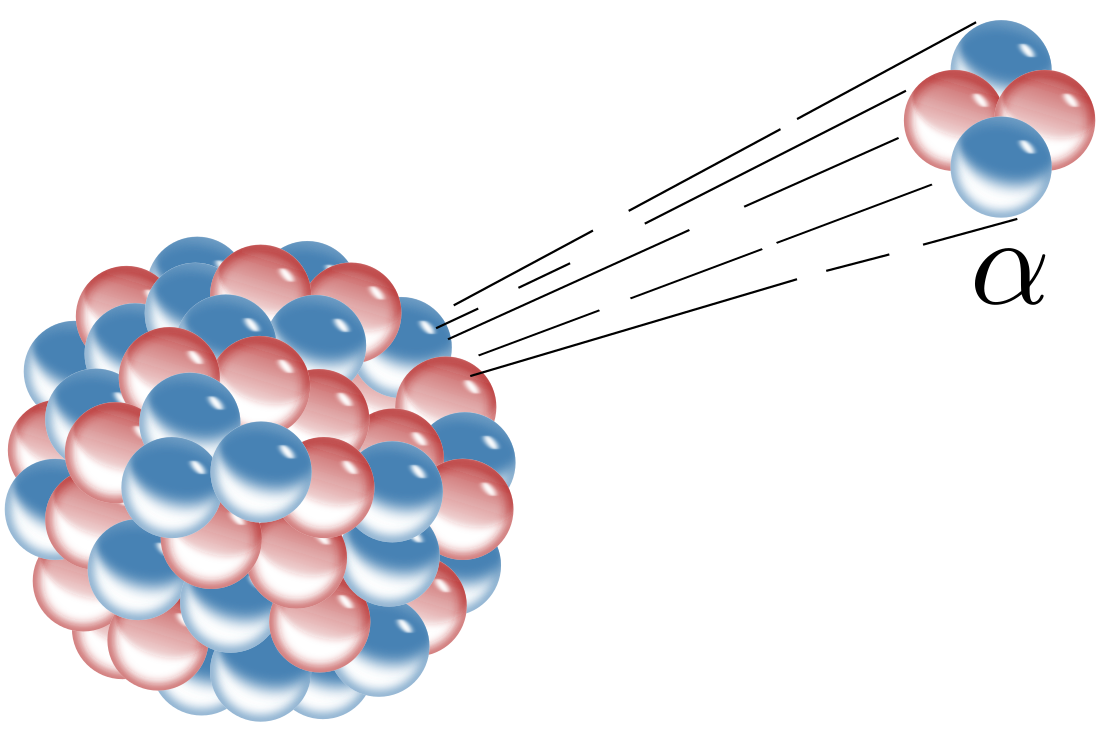
واپاشی پرتوزا (به انگلیسی: Radioactive decay) که واپاشی هستهای، پرتوزایی،[1] فروپاشی پرتوزا[2] یا فروپاشی هستهای نیز نامیده میشود، فرایندیست که در هستهٔ اتمهای ناپایدار پرتوزا رخ میدهد و پرتوهایی تولید میکند که به آنها پرتوهای رادیواکتیو میگویند. در اثر واپاشی هستهای، پس از یک زمان تصادفی، هستههای بزرگ به هستههای کوچکتر و معمولاً پایدارتر تجزیه میشوند و ماده اولیه به تدریج از بین میرود. البته جرم مواد جدید تنها اندکی کمتر از ماده اولیه خواهد بود و انرژی آزاد میشود. گاهی این انرژی را میتوان به صورت نیروی هستهای مهار کرد یا میتواند بهصورت آلودگیِ پرتوزایی در زیستبوم رها شود، که بسیار خطرناک خواهد بود. این فرایند یک پیشامد است، یعنی نمیتوان زمان واپاشی یک اتم را دقیق پیشبینی کرد، گرچه نیمهعمر آن قابل تعیین است.
| فیزیک هستهای | ||||||||
 | ||||||||
| واپاشی شکافت هستهای گداخت هستهای واپاشیهای کلاسیک | ||||||||
واپاشی آلفا · واپاشی بتا · پرتوزایی گاما · واپاشی کروی
| ||||||||
بر پایه الکترودینامیک کلاسیک، انتظار میرود که تنها ذرات باردار تابش کنند. اما گذارهای نوترونی نیز میتوانند تابش کنند، زیرا پروتونها در هسته مجبور به تغییر مکان هستند تا مرکز جرم ثابت بماند، و از سوی دیگر، نوترونها نیز مانند پروتونها به سبب داشتن گشتاورهای مغناطیسی تابش میکند.


دستهبندی واپاشیهای هستهای
واکنشهای هستهای عموماً به سه گروه زیر دستهبندی میشوند:
- واپاشی آلفا، که در آن یک ذره آلفا گسیل میشود. در این نوع پرتوزایی، یک ذره آلفا (هسته هلیم یا ) از هسته اتم خارج میشود و اتم دختر در جدول تناوبی نسبت به اتم اولیه دو خانه به عقب میرود، مانند واکنش زیر:
یا
- واپاشی بتا که در آن یک ذره بتا (الکترون یا پوزیترون) گسیل میشود. در این نوع پرتوزایی، یک الکترون (یا پوزیترون) از داخل یک نوترون (یا پروتون) خارج میشود و آن را تبدیل به یک پروتون (یا نوترون) میکند و یک پادنوترینو (یا نوترینو) خارج میشود. اتم دختر در جدول تناوبی نسبت به اتم اولیه یک خانه به جلو (یا عقب) میرود، مانند واکنش زیر:
و
- واپاشی گاما که در آن یک فوتون (بسته انرژی) گسیل میشود. در این نوع پرتوزایی، جنس اتم تغییری نمیکند، بلکه هسته اتم به دلیل انرژی که توسط واپاشی آلفا یا بتا دریافت کرده، به ترازهای انرژی بالاتر میرود. بر اساس قوانین مکانیک کوانتومی، هسته اتم به تراز اولیه برگشته و انرژی خود (که معادل اختلاف انرژی تراز بالاتر و تراز اولیه است) را به صورت یک فوتون آزاد میکند که معمولاً انرژی آن در محدوده انرژی پرتوهای گاما است، مانند واکنش زیر:
پایداری و ناپایداری ایزوتوپها
تا اوایل قرن بیستم میلادی تصور بر این بود که تمام عناصر پایدار هستند، زیرا نظریه اتمی جان دالتون بیان میکرد که اتمها نه پدید میآیند و نه از بین میروند و همه اتمهای یک عنصر، ویژگیهای یکسان دارند. ۱۸۹۶، هانری بکرل، پرتوزایی (به انگلیسی: Radioactivity) را اتفاقی کشف کرد. کشف پرتوزایی، دانشمندان را بر آن داشت تا دلیل آن را پیدا کنند. آزمایشهای ارنست رادرفورد روی این پدیده، به کشف هسته اتم انجامید. برپایه آزمایشهای رادرفورد، هسته اتم بار الکتریکی مثبت دارد که بعدها مشخص شد در اثر پروتونهاست، ولی این بهتنهایی پرتوزایی را توضیح نمیداد؛ باید عاملی میبود تا پروتونها را کنار هم نگه دارد تا در اثر نیروی کولنی میان پروتونها از فروپاشی هسته جلو بگیرد. پس از کشف نوترون ار سوی جیمز چادویک در ۱۹۳۲، به مدت کوتاهی معلوم شد که نوترون دومین ذره تشکیلدهنده هسته و عامل اصلی پایداری یا واپاشی آن است. پس از اثبات اینکه نوترون دومین ذره تشکیلدهنده هسته است، مفهومی به نام ایزوتوپ مطرح شد که بعدها از راه آزمایشهای تجربی نیز ثابت شد. ایزوتوپ ((به انگلیسی: Isotope) و (به یونانی: Ισότοπο)) به معنای «همجا» و «هممکان»، به اتمهایی از یک عنصر گفته میشود که عدد اتمی و فعالیت شیمیایی یکسان، اما عدد جرمی متفاوت دارند. پایداری این ایزوتوپها بهشمار نوترونهای آن بستگی دارد. برای نمونه، بعضی از عناصر تنها دارای یک ایزوتوپ پایدار هستند، مانند آلومینیوم و پتاسیم که تنها یک ایزوتوپ پایدار (و ) دارند و بقیه همگی ناپایدار هستند (البته بعضی از آنها ممکن است نیمهعمر بسیار طولانی داشته باشند، مانند و )، برخی دو یا چند ایزوتوپ پایدار دارند، مانند مس ( و ) و قلع (و و و …) و برخی دیگر ایزوتوپ پایداری ندارند، مانند اورانیوم (پایدارترین ایزوتوپ با نیمهعمر ۴٫۴۶۸۳ میلیارد سال) و فرانسیم (پایدارترین ایزوتوپبا نیمهعمر ۲۲ دقیقه). عناصر مصنوعی نیز عموماً نیمهعمر بسیار کوتاهی دارند، مانند اوگانسون () که در پایدارترین حالت، نیمهعمری برابر ۸۹۰ میکروثانیه دارد. معروفترین ایزوتوپها، ایزوتوپهای سهگانه هیدروژن هستند که پایین معرفی خواهند شد:
- هیدروژن معمولی () یا پروتیم (به انگلیسی: Protium) که در هسته اتمش تنها یک پروتون دارد و نوترونی ندارد. بیش از ۹۹/۹۸ هیدروژن جهان و بیشترین ماده در هستی را تشکیل میدهد.
- هیدروژن سنگین () یا دوتریم (به انگلیسی: Deuterium) که در هسته اتمش یک پروتون و یک نوترون دارد و در طبیعت نایاب است (کمتر از ۰/۰۲ درصد) است. آب سنگین () که ترکیب دوتریم و اکسیژن است، در خواص شیمیایی مانند آب معمولی است و تنها در خواص فیزیکی با آن متفاوت است. این نوع آب در نیروگاههای هستهای به عنوان خنککننده و مهارگر راکتورهای هستهای به کار میرود. نوشیدن زیاد یا طولانی این آب میتواند سبب عوارض جدی یا حتی مرگ بشود.
- هیدروژن پرتوزا () یا تریتیم (به انگلیسی: Tritium) که در هسته اتمش یک پروتون و دو نوترون دارد. این هیدروژن نیمهعمری برابر با ۸±۴۵۰۰ روز دارد و از دوتریم نیز نایابتر است. کمی از این ماده در فضا و از راه تابشهای فضایی تولید میشود و بیشتر تریتیم روی زمین، در آزمایشگاه و با راکتورهای هستهای تولید میشود. تریتیم از راه یک واکنش بتازا به هلیم-۳ تبدیل میشود:
معمولاً اگر تعداد نوترونهای هسته یک اتم ۱/۵ برابر تعداد پروتونهایش باشد، آن اتم پرتوزا میشود، ولی در یک قاعده کلی، همه عناصر سنگینتر از سرب پرتوزا هستند.
جستارهای وابسته
- نیروی هستهای ضعیف
- نیروی هستهای قوی
- تابش زمینه
- پرتوساخت (رادیوسنتز)
- حادثه چرنوبیل
- زنجیره واپاشی
- نیمهعمر
- مهندسی هستهای
- پزشکی هستهای
- داروسازی هستهای
- فیزیک هستهای
- انرژی اتمی
- واپاشی ذره
- فرایند پواسون
- پرتو
- پرتودرمانی
- آلایش هستهای
- زمانسنجی رادیومتری
- ایزوتوپ پرتوزا
- تعادل پایدار
- تعادل گذرا
- مرکز تحقیقات پزشکی هسته ای
منابع
پیوند به بیرون
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.