Trantsizio egoeraren teoria (TET) erreakzio kimiko elementalen erreakzio abiadura azaltzen duen teoria da. Teoriak onartzen du erreakzio kimikoa emateko atomo edo melekulek egoera aktibatu batetik (trantsizio egoera) pasa behar dutela, non konplexu aktibatua eratzen den, zein orekan dagoen erreaktiboekin. Konplexu aktibatuak oso energia altua du eta, ondorioz, ezegonkorra izango da eta segituan deskonposatuko da produktua emanez.
Erreakzioaren jarraipena egin daiteke energia potentzial gainalazaren aldaketan oinarrituz. Erreaktibo eta produktuei energia minimoko zonaldeak (putzuak) dagozkie, eta bi puntu hauek lotuz, energia minimoko bidea jarraituz, energia maximoko zonaldea trantsizio egoerari dagokio. Horrela, konplexu aktibatuaren eta erreaktiboen arteko energia diferentziari aktibazio energia deritzo (∆G‡). Aktibazio energia zenbat eta txikiagoa izan erreakzioa azkarrago emango da.
Teoria aldi berean garatua izan zen 1935 Henry Eyring, Princeton unibertsitatean eta Meredith Gwynne Evans eta Michael Polanyi-rengatik, Mánchester-ko unibertsitatean. Teoria hau “Konplexu aktibatuen teoria” edo “Abiadura absolutuen teoria” bezala ere ezagutzen da.
Bere hasierako helburua abiadura konstante kalkulatzea zen, zeina lortzeko energia potentzial gainazala ondo ezagutu behar den, baina ez zuen arrakasta handirik izan. Hala ere, aurretik esperimentalki abiadura konstantea kalkulatzea lortzen bada, teoriarekin aktibazio entalpia estandarra (Δ‡H°), entropia estandarra (Δ‡Sº) eta energia askea (Δ‡Gº) kalkulatu daitezke.
Svante August Arrhenius zientzialariak garatu zuen 1889an. Honen arabera erreakzio bat emateko molekulen arteko elkarrekintza bat behar da, hauen arteko talken bitartez lortzen dena, non molekulek energia altuko egoera aktibatu bat lortu behar duten. Egoera horretan aurkitzen diren molekulak konplexuak dira eta konplexu aktibatu moduan ezagutzen dira, hausten ari diren loturen eta osatzen ari diren berrien artean aurkitzen diren molekula ezegonkorrak direlarik. Zientzialari hau konturatu zen talka guztiek ez zutela energia bera ematen eta guztien artean soilik batzuk zirela molekula egoera aktibatu horretara bidali zezaketenak; hau da, erreakzioa emango zutenak. Era honetan, talka horien bereizgarritasuna hurrengoa izan behar zela ondorioztatu zuen: energia minimo bat eman behar die molekulei, non energia minimo horrek molekulak aktibatuko dituen.
Hau jakinik, Arrheniusek energia minimo hori aktibazio energia (Ea) bezala izendatu zuen. Nahiz eta logikaren ikuspuntutik guztiz zentzuzkoa den, ez zuen magnitude horren kalkulua modu zehatzean azaldu.
Teoria hau baliagarria izan zen erreakzio kimikoen jarraibideaz gehiago ezagutzeko, baina erreakzio abiadura lortzeko abiadura konstantea (k) lortzerakoan hurbilketa kualitatibo bat besterik ez zenez bertan proposatzen zen ekuazioa (guztiz esperimentala), teoría honetan oinarritua zegoen teoria aproposago baten bila jarraitu behar izan zen.
Talken teoria
Teoria honek molekulak esfera zurrunak zirela kontsideratu, eta Arrheniusen teoriarekin bat eginik, erreakzioa gertatzeko molekulen arteko talkak gertatu behar zirela adierazten zuen. Honez gain, guzti horietatik batzuk zirela erreakzioa burutuko zutenak onartu, eta talka eraginkorra izateko energia minimo bat lortzea, aktibazio-energia (Ea) adinakoa gutxienez, ezinbestekoa zela errepikatu zuen. Honez gain, baldintza berri bat proposatzen zuen beste teoriatik ezberdintzen zuena; erreaktiboetatik produktuak lortu ahal izateko talka horietan molekulek orientazio jakin bat izatea ezinbestekoa zela hain zuzen ere, honetarako molekulen egitura beharrezkoa izanik.
Talken teoriak hutsune ugari zituen. Hala nola, molekulak esfera zurrunak zirela kontsideratzea hurbilketa handiegia zen egitura jakina zuten molekula poliatomikoetan, baita teoria honetan oinarrituz aktibazio energia eta orientazioa zehazteak ekartzen zituen zailtasunak ere. Nahiz eta abiadura konstantearen balio hurbil batera inguratzea ahalbidetzen zuen, teoria berri baten beharra ikusten zuten, non molekulek zuten egitura ezberdinen eraginari garrantzia gehiago ematen zitzaion.
Nahiz eta hurbilketa moduan izan, erreakzioen zinetika ulertzen lagunduko zuen lehen ekuazio enpirikoa garatu zen.
Arrnehius-en ekuazioa
Era laburrean esanda, Arrhenius-en ekuazioak erreakzio kimikoen abiadura konstantea tenperaturarekin erlazionatzen du, honako espresioaren bidez:
- : Erreakzioaren abiadura konstantea (tenperaturaren menpekoa da).
- : Maiztasun faktorea da, faktore aurre-esponentziala da. Talken maiztasuna adierazten du eta erreakzio bakoitzaren konstante bat da.
- : Aktibazio energia. Bere unitateak sistema internazionalean J·mol-1 dira.
- : Gasen konstante unibertsala. Bere balioa sistema internazionaleko unitateetan 8,3143 J·K-1·mol-1.
- : Erreakzioa gertatzen den tenperatura Kelvin eskalan, hau da, tenperatura absolutua.
Erreakzioaren abiadura konstantea erreakzioaren zinetikarekin erlazionatuta dago eta erreakzioaren ordenaren araberakoa da, aurrerago azalduko den bezala.
Demagun honako erreakzio bat daukagula:
Erreakzioaren abiadura-legearen arabera, erreakzio abiadura erreaktiboen desagertze edota produktuen agertze abiadura bezala defini daiteke; abiadura konzentrazioaren aldakuntza denborarekiko bezala kontsideratuz. Hori jakinda, aipaturiko erreakzioarentzat erreakzio-abiadura hiru modu hauetan azal daiteke:
Erreaktibo edota produktuen konzentrazioak agertzen diren lekuetan, berez aktibitateak agertu beharko lirateke; baina konzentrazioak agertzen dira hurbilketa erabilgarri moduan. Konzentrazio efektiboak hain zuzen ere. Horrez gain, honako arbuiaketak edota sinplifikazioak aplikatzen dira: tenperatura, talken energia, gasen presio partziala, katalizatzaileen agerpena...
Bestalde, erreakzio baten abiadura-konstantea kalkulatzerako orduan, erreakzio horren orden totalak eragina dauka. Halaber, erreakzioaren orden totala erreaktiboen orden partzialen batura bezala definitzen da; erreaktibo bakoitzaren orden partziala, erreakzionatzen duten erreaktiboen partikula kopuruarekin erlazionatuta dagoelarik. Hori kontutan izanda, orden desberdineko erreakzioak existitzen dira. Jarraian lehen ordeneko erreakzio baten abiadura eta erreakzio-konstantearen kalkuluak laburtzen dira:
Lehenago erreakzio-abiadura kalkulatzeko moduei, beste espresio gehitu behar zaio; erreaktiboen orden partziala eta erreakzioaren konstante-zinetikoa kontutan hartzen dituena:
Bi espresio horiek kontutan izanda jarraian aurkezten den ekuazioa lortzen da:
Espresio hori integratzean:
Behin erreakzioen konstante-zinetikoaren informazioa ezagututa, Arrhenius-en ekuazioan agertzen den aktibazio-energia (Ea) azal daiteke. Aktibazio-energia talken ondorioz erreaktibo partikulek eduki beharreko energia minimoa da erreakzioa produktuetarantz bideratzeko trantsizio-egoera batetik igaroz. Erreaktiboen partikulek ez badute beharrezko energia minimoa, talken ondorioz partikula horiek errebotatu eta ez da erreakziorik bideratuko. Arrhenius-ek aktibazio energia logikaren ikuspuntutik bideratu zuen, baina kontzeptu teorikoa kuantifikatu ahal izateko teoria kuantikoa garatzea beharrezkoa izan zen. Hau da, aktibazio energiaren kontzeptuaren garapenak Arrhenius-en ekuazioa eta ikuspuntu kuantikoa erlazionatu zituen. Erreaktiboetatik produktuetara igarotzeko lortu beharreko trantsizio-egoera irudi honekin uler daiteke:
Energia potentzial gainazala
Energia potentzial gainazala, molekula baten edo multzo baten energia bere geometriaren funtzioan ematen duen funtzio matematikoa da. Egoera geldikorren kasuan, molekula baten energia denborarekiko independientea den Schrödinger ekuazioa erresolbatuz lortzen da.
Sistema hauen kasurako Hamiltondarra honela adierazten da:
Ekuazio hau erresolbatzea ezinezkoa denez Born-Oppenheimerren hurbilketa erabiltzen da. Hurbilketa honen arabera, nukleoen masa elektroiena baino askoz handiagoa denez, elektroien mugimendurako nukleoak finko daudela kontsideratzen da. Ondorioz,Schrödinger-en ekuazioa bitan desdoblatzen da:
(ekuazio elektronikoa)
(ekuazio nuklearra)
Hurbilketarekin jarraituz, elektroientzat nukleoen arteko errepultsioa (VNN) konstante mantentzen da. Horrela, Schrödinger-en ekuazio elektronikoa ebatziz, energia elektronikoari dagokien balorea lortu daiteke. Energia elektronikoa eta nukleoen arteko errepultsioa nukleoen posizioen menpe egoten dira. Horrela, biak batuz, nukleoek beraien mugimenduan, beste nukleoek eta elektroiek sortutako potentzial elektrostatiko totala lortuko dugu.
Horrela, V(R) R-rekiko irudikatuz, energia potentzial gainazalak lor daitezke. EPG hauek, molekulen kasuan, beraien propietateak eta erreaktibitatea aztertzeko balio dezakete.
Trantsizio egoeraren kontzeptua
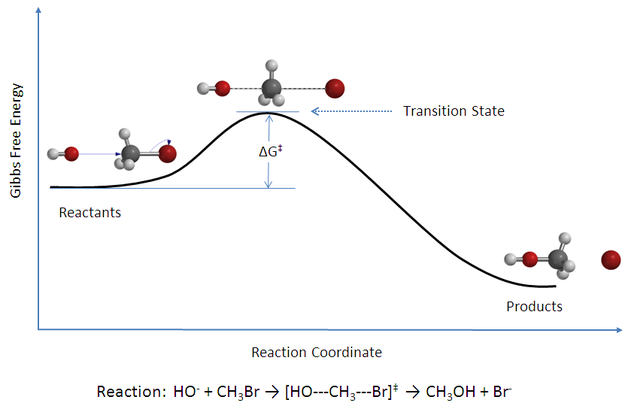
Trantsizio egoera, erreakzio kimiko batean, erreaktiboen eta produktuen geometrien artean dagoen eta energia maximoa lortzen duen egitura da. Honela, talken teoriaren ideiarekin jarraituz, molekulak arteko talkak behar dira erreakzioa emateko. Noski, teoria kuantikoari esker molekulen egiturak ulertzen ditugu, eta dagoeneko ikuspegia ez da esferen talken modukoa. Beheko irudian, erreakzio kimiko baten adibidea dugu. Ezkerrean erreaktiboak, eta eskuinean produktuak izanik, batetik bestera igarotzeko trantsizio egoera bat dugu. Trantsizio egoera honen energiak determinatuko du zein den erreakzioaren aktibazio energia, Arrheniusen ideiekin bat eginez.

Eyring-en ekuazioa
Henry Eyring, Meredith Gwynne Evans eta Michael Polanyik 1935 urtean garatutako ekuazioa da, zeinak erreakzio kimikoen abiaduran tenperaturak daukan eragina aztertzen duen. Aipaturiko ekuazioak ikuspegi klasikoaren eta ikuspegi kuantikoaren arteko loturak ezarri zituen, hau da, Arrhenius-en ekuazio enpirikoa mekanika kuantikoaren jakintzarekin erlazionatu zuen. Aipatutako ekuazioarekin daukan desberdintasun nagusia zera da, Arrhenius-en ekuazioa guztiz enpirikoa den bitartean, Eyring-en ekuazioa oinarri mekaniko estatistiko sendo batek justifikatzen du. Halaber, Arrhenius-en ekuazio enpirikoarekin antzekotasun handia du, jarraian ikus daitekeen bezala:
- : Erreakzioaren abiadura konstantea. Tenperaturaren menpekoa da.
- : Transmisio koefizientea. Mekanika kuantikoan erabiltzen den terminoa da, zeinak uhinen portaera azaltzen duen oztopo baten aurrean. Zehazki, partikula batek tunel efektua pairatzeko daukan probabilitatearekin dago erlazionatuta.
- : Boltzmann konstantea. Gas partikulen energia zinetikoa eta tenperatura erlazionatzen dituen konstantea da.
- : Tenperatura absolutua (Kelvin-etan).
- : Planck-en konstantea. Quantum-en teoriaren konstante unibertsala da.
- : Trantsizio fasera iristeko beharrezkoa den Gibbs-en aktibazio energia askea.
- : Gasen konstante unibertsala. Bere balioa sistema internazionaleko unitateetan 8,3143 J·K-1·mol-1.
Gibbs-en aktibazio energia askearen definizioa kontutan hartuta, Eyring-en ekuazioa beste modu honetan berridatzi daiteke:
Azken ekuazio hau berrantolatuz, ohikoa den espresioa lortzen da:
Espresio ohikoena da bere erabiltzeko erraztasunagatik. Izan ere, laborategian neurgarriak diren magnitudeekin modu errazean lan egin daiteke.
Molekulen geometriak errepresentatzeaz gain, energia potentzial gainazala kalkulatzen badugu goiko erreakziorako, beheko irudia lortuko genuke. Irudian agertzen diren energia minimoak molekulen erreaktibo eta produktuen geometriei dagozkie. Minimo batetik bestera pasatzeko sistemak maximo batetik pasa behar du. Maximo honi dagokion egitura da, hain zuzen ere, trantsizio egoera. Erreaktiboen eta trantsizio egoeraren artean dagoen energia diferentzia da, hain zuzen ere, aktibazio energia, eta honek erreakzioaren zinetika baldintzatzen du. Energia langa hau handiegia bada, erreakzioa ezingo litzateke eman. Txikia bada, gaindigarria da eta erreakzioa eman daiteke. Bestalde, erreaktibo eta produktuen arteko diferentziak adieraziko digu erreakzioa endotermikoa ala exotermikoa den. Modu honetan, esperimentuetan neurtutako balioak eta kimika kuantikoaren bidez kalkulatutakoak bat datoz orokorrean, eta lortutako emaitza esperimentalei azalpen teorikoa eman dakieke.
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.







![{\displaystyle v=-{d[A] \over dt}={d[B] \over dt}={d[C] \over dt}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/844f828b7631747eff99c3c5e63b1a70d440a4e2)
![{\displaystyle v=k\cdot [A]}](http://wikimedia.org/api/rest_v1/media/math/render/svg/42eb21c606220837e1471127f550f2761ff8736e)
![{\displaystyle -{d[A] \over dt}=k\cdot [A]\longrightarrow {d[A] \over [A]}=-k\cdot dt}](http://wikimedia.org/api/rest_v1/media/math/render/svg/b4ed48dc58c1e61329064b6cfd7173e11499f583)
![{\displaystyle \int _{[A]_{0}}^{[A]}{d[A] \over [A]}=-k\int _{0}^{t}dt\longrightarrow ln{[A] \over [A]_{0}}=-k\cdot t\longrightarrow [A]=[A]_{0}\cdot e^{-k\cdot t}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/fa0e00b7f56605a8ca621477931a8641e97d2f64)















