Erredox edo erredukzio-oxidazio deritze erreaktiboen oxidazio-egoera aldatzen duten erreakzio kimikoei. Erredukzioa erreaktibo baten oxidazio-egoera murriztea da, eta oxidazioa berriz handitzea. Maiz, baina ez beti, elektroi-transferentzia bat dago, erreaktibo batek elektroiak irabazten ditu erreduzitzean eta galdu oxidatzean. Horrela, oxidatzen den erreaktiboa erreduktorea da, eta erreduzitzen dena oxidatzailea. Prozesu bat ezin da bestea gabe gertatu, erreaktibo bat oxidatzean beste bat erreduzitzen da.[1]

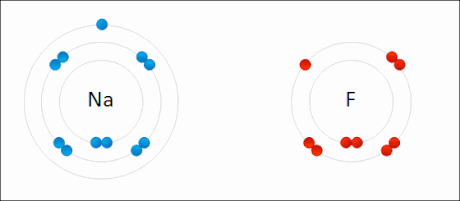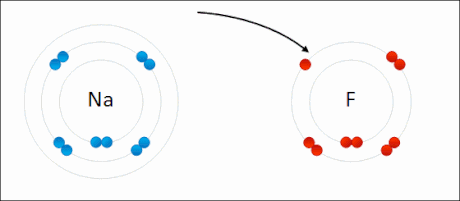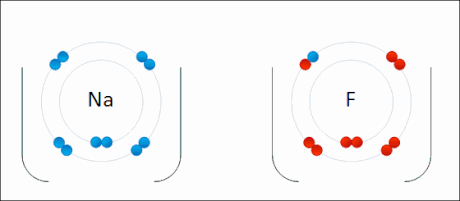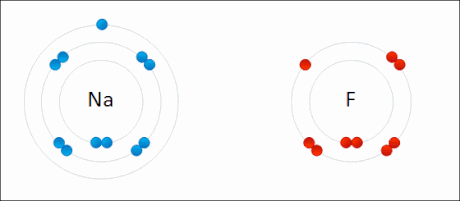
Sodio fluoruroaren sintesia erredox erreakzio baten adibide da.
- Na + 1⁄2 F2 → NaF
Erreaktiboak elementuak direnez, beraien oxidazio-egoera 0 da. Sodioak elektroi bat galtzen du, bere oxidazio-egoera 0tik +1ra igoz, ondorengo erdi-erreakzioak adierazten duen bezala.
- Na → Na+ + e−
Aldiz, fluorrak elektroi hori irabazten du, bere oxidazio-egoera 0tik −1era jaitsiz.
- 1⁄2 F2 + e− → F−
Hortaz, erreakzioan sodioak erreduktore bezala jarduten du fluorrarekiko, bere burua oxidatuz prozesuan. Aldi berean, fluorrak oxidatzaile bezala jarduten du sodioarekiko, bere burua erreduzituz.
Erredox motako erreakzioak oso ohikoak dira, adibide bezala errekuntza, herdoilketa, metalen extrakzioa menetatik, baterien funtzionamendua eta glukosaren oxidazioa izanik.
Erredox ez diren erreakzioak
Ugariak diren arren, badaude erredox ez diren erreakzioak, azido sulfurikoaren sintesia esaterako.
- SO3 + H2O → H2SO4
Elementu bakoitzaren oxidazio-egoera ez da aldatu erreakzioan: hidrogenoa (+1), oxigenoa (−2) eta sufrea (+6).
Ioien parte-hartzeak ere ez du bermatzen erreakzioa erredox izatea, karbonato ioiaren protonazioa adibide izanda.[2]
- CO2−
3 + 2 H+ → CO2 + H2O
Erreaktibo ionikoak produktu molekular bilakatu diren arren, elementuen oxidazio-egoerak ez dira aldatu: hidrogenoa (+1), karbonoa (+4) eta oxigenoa (−2).
Erredox erreakzioen doiketa
Erredox erreakzio batzuen doiketa errazagoa da metodo sistematiko baten bidez.
Ingurune azidoetan
- Banatu erreakzioa oxidazio eta erredukzio erdi-erreakzioetan.
- Erdi-erreakzio bakoitzean doitu elementu guztiak, hidrogenoa eta oxigenoa izan ezik.
- Doitu oxigeno atomoak, ura jarriz falta den aldean.
- Doitu hidrogeno atomoak, protoiak jarriz falta den aldean.
- Doitu kargak, elektroiak jarriz falta den aldean.
- Bidertu erdi-erreakzio bakoitza elektroi kopurua bera izan dadin, eta ondoren ekuazio batera konbinatu.
Doiketa-adibide bezala sulfito eta manganatoaren arteko erreakzioa erabiliko dugu.
- SO2−
3 + MnO−
4 → SO2−
4 + Mn2+
Sulfitoa oxidatu egiten da sulfatoa emateko, sufrearen oxidazio-egoera +4tik +6ra igotzen delako. Manganatoa aldiz erreduzitu egiten da manganeso ioia emateko, manganesoaren oxidazio-egoera +7tik +2ra jaisten delako. Hortaz, sulfitoa erreduktorea da eta manganatoa oxidatzailea. Erdi-erreakzioak adierazi.
- SO2−
3 → SO2−
4 - MnO−
4 → Mn2+
Hidrogenoa eta oxigenoa ez diren elementuak jada doituta daudenez, oxigenoa doitzen hasi. Oxidazioak ur molekula bat behar du erreaktiboetan eta erredukzioak lau produktuetan.
- SO2−
3 + H2O → SO2−
4 - MnO−
4 → Mn2+
+ 4 H2O
Orain ur molekulek jarritako hidrogenoak doitu protoiak gehituz falta den aldean. Oxidazioak bi protoi behar ditu produktuetan eta erredukzioak zortzi erreaktiboetan.
- SO2−
3 + H2O → SO2−
4 + 2 H+ - MnO−
4 + 8 H+ → Mn2+
+ 4 H2O
Orain bi aldeetako kargak berdindu. Oxidazioan karga −2 da erreaktiboetan eta 0 produktuetan, hortaz 2 elektroi jarri produktuetan berdintzeko. Erredukzioan karga +7 da erreaktiboetan eta +2 produktuetan, hortaz 5 elektroi jarri erreaktiboetan.
- SO2−
3 + H2O → SO2−
4 + 2 H+ + 2 e− - MnO−
4 + 8 H+ + 5 e− → Mn2+
+ 4 H2O
Erdi-erreakzio bakoitza bidertu elektroi kopurua bera izan dadin. Oxidazioa bi aldiz bidertu eta erredukzioa bost aldiz.
- 5 SO2−
3 + 5 H2O → 5 SO2−
4 + 10 H+ + 10 e− - 2 MnO−
4 + 16 H+ + 10 e− → 2 Mn2+
+ 8 H2O
Orain erdi-erreakzioak batu.
- 5 SO2−
3 + 2 MnO−
4 + 5 H2O + 16 H+ + 10 e− → 5 SO2−
4 + 2 Mn2+
+ 8 H2O + 10 H+ + 10 e−
Ura, protoiak eta elektroiak bi aldeetan agertzen direnez, ekuazioa sinplifikatu espezie espektadoreak kenduz; alde gutxienaren kantitatea bi aldeetatik kenduz. Behin doiturik, erreakzioa honela geratuko da.
- 5 SO2−
3 + 2 MnO−
4 + 6 H+ → 5 SO2−
4 + 2 Mn2+
+ 3 H2O
Doiketa zuzena dela egiaztatzeko, bermatu bi aldeetan dauden elementu eta karga-kopurua bera dela.
| H | O | S | Mn | q | |
|---|---|---|---|---|---|
| Erreaktiboak | 6 | 23 | 5 | 2 | −6 |
| Produktuak | 6 | 23 | 5 | 2 | −6 |
Ingurune basikoetan
- Banatu erreakzioa oxidazio eta erredukzio erdi-erreakzioetan.
- Erdi-erreakzio bakoitzean doitu elementu guztiak, hidrogenoa eta oxigenoa izan ezik.
- Doitu oxigeno atomoak, ura jarriz falta den aldean.
- Doitu hidrogeno atomoak, protoiak jarriz falta den aldean.
- Doitu kargak, elektroiak jarriz falta den aldean.
- Begiratu zenbat protoi dagoen erdi-erreakzio bakoitzean eta gehitu bi aldeetan horrenbeste hidroxilo. Hidroxiloak eta protoiak alde berean agertzen direnean konbinatu ur molekula bezala.
- Bidertu erdi-erreakzio bakoitza elektroi kopurua bera izan dadin, eta ondoren ekuazio batera konbinatu.
Adibide bezala manganato eta zianuroaren erreakzioa erabiliko dugu.
- CN−
+ MnO−
4 → OCN−
+ MnO
2
Zianuroa oxidatu egiten da zianatoa emanez, karbonoaren oxidazio-egoera +2tik +4era igotzen delako. Manganatoa erreduzitu egiten da manganeso dioxidoa emateko, manganesoaren oxidazio-egoera +7tik +4era jaisten delako. Erdi-erreakzioak adierazi.
- CN−
→ OCN− - MnO−
4 → MnO
2
Hidrogenoa eta oxigenoa ez diren elementuak jada doituta daudenez, oxigenoak doitu ur molekulak jarriz. Oxidazioak ur molekula bat behar du erreaktiboetan eta erredukzioak bi produktuetan.
- CN−
+ H
2O → OCN− - MnO−
4 → MnO
2 + 2 H
2O
Hidrogenoak doitu protoiak jarriz. Oxidazioak bi protoi behar ditu produktuetan eta erredukzioak lau erreaktiboetan.
- CN−
+ H
2O → OCN−
+ 2 H+ - MnO−
4 + 4 H+
→ MnO
2 + 2 H
2O
Kargak berdindu elektroiak jarriz falta den tokian. Oxidazioan karga −1 da erreaktiboetan eta +1 produktuetan, hortaz bi elektroi jarri produktuetan. Erredukzioan karga +3 da erreaktiboetan eta 0 produktuetan, hortaz hiru elektroi jarri erreaktiboetan.
- CN−
+ H
2O → OCN−
+ 2 H+
+ 2 e− - MnO−
4 + 4 H+
+ 3 e− → MnO
2 + 2 H
2O
Bidertu erdi-erreakzio bakoitza elektroi kopurua bera izan dadin. Oxidazioa hiruz aldiz bidertu eta erredukzioa bi aldiz.
- 3 CN−
+ 3 H
2O → 3 OCN−
+ 6 H+
+ 6 e− - 2 MnO−
4 + 8 H+
+ 6 e− → 2 MnO
2 + 4 H
2O
Orain, ingurune basikora aldatzeko, gehitu alde bakoitzean protoien kantitatea hidroxiloetan. Oxidazioan 6 protoi daude produktuetan, hortaz 6 hidroxilo jarri bi aldeetan. Erredukzioan 8 protoi daudenez, 8 hidroxilo jarri bi aldeetan.
- 3 CN−
+ 3 H
2O + 6 OH−
→ 3 OCN−
+ 6 H+
+ 6 OH−
+ 6 e− - 2 MnO−
4 + 8 H+
+ 8 OH−
+ 6 e− → 2 MnO
2 + 4 H
2O + 8 OH−
Hidroxiloak eta protoiak batera badaude alde batean, konbinatu ur molekula bezala.
- 3 CN−
+ 3 H
2O + 6 OH−
→ 3 OCN−
+ 6 H
2O + 6 e− - 2 MnO−
4 + 8 H
2O + 6 e− → 2 MnO
2 + 4 H
2O + 8 OH−
Gehitu bi erdi-erreakzioak.
- 3 CN−
+ 2 MnO−
4 + 6 OH−
+ 11 H
2O + 6 e− → 3 OCN−
+ 2 MnO
2 + 8 OH−
+ 10 H
2O + 6 e−
Sinplifikatu espezie espektadoreak eta elektroiak kenduz. Ekuazioa honela geratuko da.
- 3 CN−
+ 2 MnO−
4 + H
2O → 3 OCN−
+ 2 MnO
2 + 2 OH−
Orain egiaztatu bi aldeetan dauden elementu eta karga-kopurua bera dela.
| H | C | N | O | Mn | q | |
|---|---|---|---|---|---|---|
| Erreaktiboak | 2 | 3 | 3 | 9 | 2 | −5 |
| Produktuak | 2 | 3 | 3 | 9 | 2 | −5 |
Dismutazio erreakzioak
Erredox erreakzio batzuetan erreaktibo bera da oxidatzaile eta erreduzitzailea, hidrogeno peroxidoaren deskonposaketan adibidez.
- 2 H
2O
2 → 2 H
2O + O
2
Hidrogeno peroxido molekula batek beste bat erreduzitzen du, prozesuan oxidatuz eta oxigeno molekular bilakatuz (oxigenoaren oxidazio-egoera −1etik 0ra igoz). Erreduzitzen den hidrogeno peroxido molekula ur bilakatzen da (oxigenoaren oxidazio-egoera −1etik −2ra jaitsiz).
Erreferentziak
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.