From Wikipedia, the free encyclopedia
Tsüsteiin (süstemaatiline nimetus: 2-amino-3-sulfhüdrüülpropaanhape) on looduslik aminohape, mis sisaldab külgahelas tioolrühma. Looduses esineb tsüsteiin L-isomeerina ning valkude koostises leiduvat tsüsteiinijääki (tähis Cys) kodeerib DNA tasemel nukleotiidijärjestus TGT või TGC ning vastavalt mRNA tasemel järjestus UGU või UGC.[1][2]

Täiskasvanud inimese organism suudab tsüsteiini toota teistest aminohapetest (seriinist ja metioniinist), mistõttu ei kuulu tsüsteiin asendamatute aminohapete hulka. Küll on tsüsteiin aga asendamatu enneaegselt sündinud vastsündinutele, sest nende rakud ei tooda veel funktsionaalset ensüümi tsüstationaasi, mis on oluline tsüsteiini sünteesiks organismis.[3][4]
L-tsüsteiini CAS number on 52-90-4 ja D-tsüsteiini CAS number on 921-01-7. Kommertsiaalselt on tsüsteiin kättesaadav ka soola kujul (nt vesinikkloriidhappe soolana) ja hüdraadina.[5][6][7]

Nagu teisedki looduslikud kiraalsed aminohapped esineb ka tsüsteiin ja tsüsteiinijääk looduses valdavalt L-isomeerina (D/L-nomenklatuuri kohaselt). R/S-nomenklatuuri kohaselt on aga tsüsteiin erandlik: kui teised kiraalsed aminohapped esinevad looduses valdavalt S-isomeeridena, siis tsüsteiin esineb R-isomeerina. See on tingitud asjaolust, et tsüsteiin on ainus aminohape, mille külgahelas on hapnikust suurema aatommassiga element. Seega on R/S-nomenklatuuri kohaselt tioolrühma nn vanus asendajana suurem kui karboksüülrühma hapnike oma.[8]

Tsüsteiini ülesanded organismis on suuresti seotud tioolrühma nukleofiilsete omadustega. Kuna tsüsteiini tioolrühma pKa väärtus on 8,33, siis võib see füsioloogilise pH juures esineda ka deprotoneeritud kujul (st tiolaat-anioonina). Tiolaat on veelgi tugevam nukleofiil kui tiool.[5][9]
Tioolrühm võimaldab tsüsteiinil osaleda ka redoksreaktsioonides. Tioolrühm (R-SH) võiks oksüdeeruda kuni sulfoonrühma moodustumiseni (R-SO3-), kuid organismi seisukohalt on olulisem tioolrühma oksüdeerumine disulfiidiks (R-S-S-R). Väävel paikneb perioodilisustabelis hapnikuga samas rühmas (VIA), kuid erinevalt peroksiididest on disulfiidrühmad oluliselt stabiilsemad. Kahe tsüsteiinijäägi tioolrühmadest moodustunud disulfiidside võib tagada nii ühe valgumolekuli ruumilise kuju koospüsimist (kui mõlemad Cys kuuluvad sama valgumolekuli koostisse) kui valkude kompleksi kvaternaarset struktuuri (kui Cys jäägid kuuluvad eri ahelatesse). Disulfiidsideme ehk disulfiidsilla kaudu ühendatud kahest tsüsteiinijäägist koosnevat molekuli nimetatakse ka tsüstiiniks.[10][11]

Tsüsteiini üks olulisemaid rolle on seotud kuulumisega tripeptiidi glutatiooni koostisse. Glutatioon esineb rakkudes millimolaarses kontsentratsioonis ja reguleerib raku redokstasakaalu just tänu tsüsteiini tioolrühma võimele pöörduvalt moodustada disulfiidsidet. Sel viisil käitub glutatioon rakkudes antioksüdandina, oksüdeerudes ise ning kaitstes rakusiseseid komponente liigreaktiivsete hapnikuühendite (nt vabade radikaalide) eest.[12]

Nagu eespool mainitud, omab disulfiidside olulist rolle ka valgumolekulide ja nendest koosnevate kompleksite ruumiliste struktuuride kooshoidmisel. Tsüsteiinijääkide vahendusel tagatakse näiteks mitmeahelaliste funktsionaalsete antikehade ehk immunoglobuliinide (nt IgG, IgM) moodustumine.[13][14]
Tänu tioolrühma nukleofiilsetele omadustele võib tsüsteiinijääk võib mängida olulist rolli ka ensüümide aktiivtsentrites katalüüsi vahendajana. Selliste ensüümide alla kuuluvad näiteks tsüsteiinproteaasid (ehk tsüsteiinsõltuvad proteaasid) – sealhulgas kaspaasid, mis on tuntud kui raku programmeeritud surma ehk apoptoosi kesksed läbiviijad.[15][16] Samuti on tsüsteiini tioolrühma deprotoneerumisel tekkiv tiolaatioon oluline DNA paranduses osaleva valgu O-6-metüülguaniin-DNA metüültransferaasi (lühendatult ka MGMT) ülesannete täitmiseks.[17]
Tiolaatiooni negatiivse laengu ning vabade elektronpaaride vahendusel saab tsüsteiin moodustada komplekse ka d-metallide ioonidega, mille aatomites on olemas vabad orbitaalid. Nii kuulub tsüsteiin mitmete redoks-aktiivsete ensüümide heemide koostisse, näiteks tsütokroom C (oluline hingamisahelas) või tsütokroom P450 (oluline ainevahetuse seisukohalt, vastutab mitmete ühendite lagundamise eest).[18][19] Tsüsteiini võime moodustada komplekse raskmetallidega on oluline ka organismi võime seisukohalt vältida raskmetallimürgistust, kuid loomulikult saavad need kaitsemehhanismid toimida vaid raskmetallide teatud kontsentratsioonideni.[20][21]
Tsüsteiini sisaldus on suhteliselt suur keratiinides (valkude perekond, mida leidub rohkesti selgroogsete loomade nahas, karvades, sulgedes, küüntes jms). Nendes fibrillaarsetes valkudes tagavad tsüsteiinide tioolrühmade vahendusel tekkinud disulfiidsillad struktuuri mehaanilist sitkust. Seepärast on tsüsteiin ka üks väheseid aminohappeid, mida toodetakse tööstuslikult enamasti just loomset päritolu keratiinirikaste materjalide (nt kanasulgede) hüdrolüüsi teel.[22]
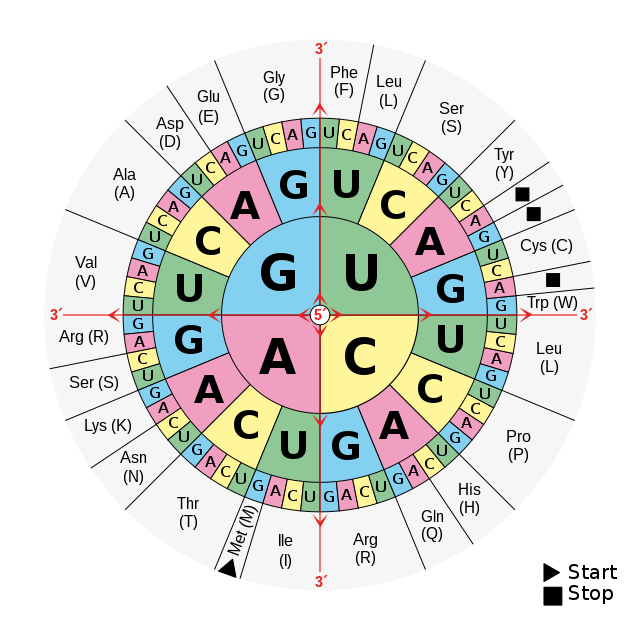
DNA tasemel tekkinud vead (mutatsioonid), mis peegelduvad mRNA nukleotiidjärjestuses ning edaspidi ka valgu aminohappelises järjestuses, võivad olla rohkem või vähem patogeensete tulemustega (olenevalt sellest, kui palju muutub valgu võime täita oma rolli organismis). On näidatud, et tsüsteiinijäägi (Cys) mutatsioonid on suure tõenäosusega väga patogeensed – Cys asendatakse enamasti kas arginiinijäägi (Arg) või türosiinijäägiga (Tyr), mis on keemilistelt omadustelt tsüsteiinist oluliselt erinevad. Ka vastupidised mutatsioonid (Arg → Cys, Tyr → Cys) on suhteliselt levinud ja samuti patogeensed.[23]

Nagu kõigi elusraku komponentide puhul võib ka tsüsteiini sisaldavate valkude või peptiidide anomaalne hulk rakus käivitada haiguste teket või aidata kaasa haiguse arengule. Näiteks on glutatiooni kui antioksüdandi anomaalselt madalat taset seostatud mitmete patoloogiliste seisunditega, sh neurodegeneratiivsete haigustega.[25][26] Samas on tsüsteiini sisaldav ensüüm MGMT (vt ka eespool) küll vajalik DNA parandusmehhanismide seisukohalt, kuid selle ülehulk aitab kaasa vähkkasvajate (eriti glioomi) resistentsuse tekkele. Nimelt põhineb mitmete vähiravimite, sealhulgas mitmete keemiaravimite toime vähirakkude DNA vigastamisel – kui aga vigastused parandatakse, ei suuda ravimid oma toimet realiseerida.[27][28]
Teisalt võib tsüsteiinijäägi olemasolu valgus hoopis soodustada vähiravimite väljatöötamist. Näiteks on sihtmärkravis muutunud viimasel aastakümnel populaarseks nn pöördumatute inhibiitorite arendamine, mis moodustavad bioloogilise sihtmärgiga (ensüümiga, enamasti teatud türosiinkinaasiga) kovalentse kompleksi. Sel viisil püsivad inhibiitorid pikemalt sihtmärgi küljes ning takistavad efektiivsemalt ensüümi tööd, mis muidu soodustaks vähi vohamist. Pöördumatute inhibiitorite molekulis peab seega sisalduma reaktsioonivõimeline funktsionaalrühm, mis reageeriks ensüümi mõne aminohappejäägiga. Kuna tsüsteiinijäägi tioolrühm on suhteliselt reaktiivne, siis ongi seni arendatud pöördumatuid inhibiitoreid just selliste ensüümide jaoks, kus tsüsteiinijääk on inhibiitori jaoks suhteliselt kergesti kättesaadav (nt Brutoni türosiinkinaas, epidermaalse kasvufaktori retseptorid 1 ja 2).[29][30]

Veel üks haiguslik seisund, mis on seotud tsüsteiini tioolrühma oksüdeerumisel moodustuva tsüstiiniga, on tsüstinuuria. Tsüstinuuria on autosoomne retsessiivne haigus, mis on tingitud mutatsioonidest geenides SLC3A1 või SLC7A9. Nende geenide poolt kodeeritud valgud on nn transporterid, mis vastutavad tsüstiini absorbtsiooni eest tagasi vereringesse. Valkude muteerumisel tekivad tsüstiini imendusmishäired neerutorukestes, mis omakorda tingivad tsüstiini kristallumist ja neerukivide teket.[31]

Tsüsteiini olulisim ravimina kasutatav derivaat on N-atsetüültsüsteiin, milles tsüsteiini aminorühm on derivatiseeritud atsetüülrühmaga. See struktuurne muudatus parandab tsüsteiini imendumist maos, kuid organismis toimub ajapikku atsetüülrühma hüdrolüüs ja tsüsteiini taasteke.[32][33]

N-atsetüültsüsteiini kasutatakse nii antidoodina paratsetamoolimürgistuse puhul kui rögalahtistina hingamisteede haiguste korral. Paratsetamoolimürgistuse korral kasutatakse ära asjaolu, et tsüsteiini kättesaadavus piirab rakkudes glutatiooni tootmist. Glutatiooni hulga suurenedes reageerib glutatioonis sisalduv Cys tioolrühm paratsetamoolist tekkitud mürgise metaboliidiga (bensokinoon NAPQI), moodustades mittemürgist saadust.[34][35]
N-atsetüültsüsteiini rögalahtistav toime on samuti seotud tioolrühmaga, mis tekitab disulfiidsidemeid lima koostisse kuuluvate valkude tsüsteiinijääkidega. Nimelt on lima koostises olevad valgud omavahel seotud molekulidevaheliste disulfiidsildadega. Kui N-atsetüültsüsteiini hulk on suur, siis on suurem ka tõenäosus, et valgu koostisse kuuluv Cys moodustab disulfiidsidet just N-atsetüültsüsteiiniga, mitte naabervalgu tsüsteiinijäägiga. Kuna N-atsetüültsüsteiini molekul on valgumolekulist väiksem, siis aitabki N-atsetüültsüsteiin lõhkuda disulfiidsildu valgumolekulide vahel ja vedeldada lima.[36][37]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.