Toxoplasma gondii
protozoo parásito causante de la toxoplasmosis De Wikipedia, la enciclopedia libre
Toxoplasma gondii es una especie de protozoo parásito intracelular obligado, eucariota. Es causante de la toxoplasmosis, una enfermedad, en general, leve pero que puede complicarse hasta convertirse en fatal, especialmente en los gatos y en los fetos humanos.[1] El ciclo celular de T. gondii alterna entre la reproducción sexual en los huéspedes definitivos y la reproducción asexual en los huéspedes intermedios. El gato y otros felinos son considerados como sus hospedadores definitivos porque en ellos tiene lugar la fase sexuada de su ciclo de vida. Entre los huéspedes intermedios podemos encontrar mamíferos y pájaros.[2] Es un parásito muy exitoso y uno de los más frecuentes que infectan a los humanos, pues puede infectar a cualquiera de las especies de animales homeotermos. Los humanos son hospedadores habituales, en 2002 se estimaba que un tercio de la población mundial estaba infectada de forma crónica por T. gondii.[3]

Morfología
Resumir
Contexto

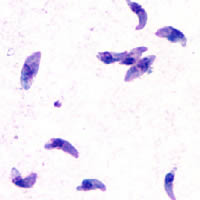
Las distintas fases de desarrollo del Toxoplasma gondii muestran cambios importantes en su morfología, estas son llamadas: #Taquizoito, #Bradizoito y #Ooquiste.
El Taquizoito es la forma de la infestación aguda, tiene de 4-8 micrómetros (μm) (micrómetros) de longitud y de 2-4 μm de ancho, con aspecto de medialuna.
Un grupo de estructuras moleculares, en un extremo del Taquizoito del T. gondii, con la denominación de complejo apical, es fundamental tanto para la invasión como para la proliferación de este parásito.[4][5]
Complejo apical

Conoide Citoesqueleto y membrana plasmática externa (negra) y dos membranas adicionales (IMC, roja) formadas por vesículas aplanadas (sacos alveolares).


El complejo apical (api-complex en inglés) de T. gondii, es un conjunto complejo de elementos estructurales y secretores en el extremo apical del parásito adulto, que se construye sobre un conjunto de fibras dispuestas en espiral alrededor del conoide. Este complejo tiene también tres unidades de membrana (como se ve en el esquema C): una membrana plasmática externa (en negro) y dos membranas en el complejo de membrana interna (IMC en rojo) que son las paredes de vesículas aplanadas (sacos alveolares).[6]
El complejo apical proporciona un marco semirrígido para las células puntiagudas de T. gondii y es el destino para los orgánulos secretores, que liberan varios factores de invasión.[7]
El complejo apical se organiza alrededor de un anillo polar apical (APR en inglés), que sirve como centro organizador y nuclea una serie de microtúbulos, que descienden hacia la parte posterior de la célula.
Además de su estructura, el complejo apical actúa como un centro de señalización, al ser el punto de convergencia de muchas vías reguladoras.[8]
Conoide
El conoide de T. gondii, está formado por un conjunto compacto de fibras de citoesqueleto dispuestas en espiral, que se mueven activamente durante la etapa de invasión de las células del huésped.
Las estructuras asociadas con el conoide son: los anillos pre-conoidales, en la punta distal del conoide, donde se originan las fibras conoides; el anillo polar, del que se originan 22 microtúbulos (MT) sub-peliculares; y dos MT intra-conoidales cortos, que pueden utilizarse como vías para el transporte de vesículas secretoras esenciales para la invasión.[6]

Pasada la etapa de invasión de T. gondii, se forma la llamada vacuola parasitófora (PV). Esta se forma tanto de la membrana plasmática de la célula huésped, como de los productos de secreción del parásito.
La vacuola PV está aislada del tráfico vesicular del huésped y está rodeada por microtúbulos, por retículo endoplásmico y por mitocondrias de la célula huésped.
T. gondii también posee orgánulos secretores especializados: las micronemas (M), las roptrías (R) y los gránulos densos (DG). La secreción en secuencia de estos tres tipos de orgánulos secretores dirigen tanto la entrada en la célula huésped, como la formación de la PV.[9]
Ooquiste
Un ooquiste es la fase esporulada del Toxoplasma. Este es un estado que puede sobrevivir fuera del hospedador por largos períodos de tiempo, dada su alta resistencia al medio ambiente. Esta es la forma durmiente del parásito, el producto de su reproducción sexual en las células intestinales de los felinos infectados. Estos pueden segregar ooquistes hasta 1 o 2 semanas después de la infección. Estos ooquistes esporulan y se hacen efectivos en 1-5 días y gracias a su gruesa pared celular pueden sobrevivir bien en el medio ambiente.[10]
Bradizoíto
El bradizoíto (del griego brady=lento y zōon=animal) es la forma de replicación lenta del parásito, no solamente de Toxoplasma gondii, sino de otros protozoos responsables de infecciones parasitarias. En la toxoplasmosis latente (crónica), el bradizoíto se presenta en conglomerados microscópicos envueltos por una pared llamados quistes, en el músculo y el tejido cerebral infectado.[11]
Taquizoito

Los taquizoitos son formas mótiles que forman pseudoquistes en tejidos infestados por toxoplasma. Los taquizoitos se encuentran en vacuolas dentro de las células, esta forma celular invade y se replica en las células infectadas. Activan el sistema inmune y se convierten en bradizoitos que se dividen lentamente.
Algunos de los orgánulos que pueden ser encontrados en la imagen de microscopía electrónica de la derecha son:
apicoplasto (A); anillo polar apical (APR); conoide (C); anillo conoidal (CR); aparato de Golgi (G); complejo de membrana interna (IMC); Micronemas (M); mitocondria (Mi); microtúbulos (Mt); núcleo (Nu); roptrias (R); conducto de roptria (RD); vacuola (V).
Genoma y Cepas
- La mayoría de las cepas de T. gondii del mundo pertenecen a tres linajes clonales distintos (tipo I, tipo II y tipo III) con diferencias genéticas mínimas entre ellos. Sin embargo, estos T. gondii muestran una virulencia variada.
- El T. gondii tipo I está representado por las cepas GT1 y la RH (aislada de un caso de encefalitis inducida por toxoplasmosis fatal en el año 1939). La cepa RH se ha adaptado al cultivo in vitro y se utiliza comúnmente en el trabajo de laboratorio. El tipo I también se asocia con toxoplasmosis congénita grave en los países europeos. El tipo II domina la toxoplasmosis humana en Estados Unidos está representado por la cepa ME49. El tipo III se asocia significativamente con huéspedes animales y está representado por las cepas VEG y CEP.[12]
Ciclo de vida
Resumir
Contexto

El ciclo de vida del T. gondii tiene dos fases. La fase sexual del ciclo de vida ocurre solo en miembros de la familia Felidae (gatos domésticos y salvajes), haciendo que estos animales sean los hospedadores primarios del parásito. La fase asexual del ciclo de vida puede ocurrir en cualquier animal de sangre caliente, tales como otros mamíferos y aves. Por ello, la toxoplasmosis constituye una zoonosis parasitaria.[13]
Este protozoario puede infectar de tres formas por medio de:
Taquizoítos: encontrados en psedoquistes, estos son liberados de los bradizoítos y penetran cualquier célula infectandola hasta morir.
Bradizoítos: estos entran en forma de quiste al hospedero, donde pueden liberar taquizoítos o en el caso de hospederos de la familia Felinidae, pueden formar gametos para después conformar un ooquiste.
Ooquiste: esta última forma de infección solo es producida en los hospederos de la familia Felinidae, pues solo es estos se puede llevar a cabo el ciclo sexual del protozoario. Estos se forman a partir de los gametos femeninos y masculinos que nacieron de los bradizoítos. En estos se encuentran 2 sacos con 4 taquizoítos cada uno y son liberados en las heces.
La forma de infección se puede dar desde consumir agua o alimentos que estén infectados con el protozoario, hasta la ingesta de carne con quistes o pseudoquistes.[14]
En el hospedador intermediario, incluyendo los felinos, los parásitos invaden células, formando un compartimento llamado vacuola parasitófora[15] que contienen bradizoitos, la forma de replicación lenta del parásito.[16] Las vacuolas forman quistes, en especial en los músculos y cerebro. Debido a que el parásito está dentro de las células, el sistema inmunitario del hospedador no detecta estos quistes. La resistencia a los antibióticos varía, pero los quistes son difíciles de erradicar enteramente.
Estructura de T. gondii en etapa inicial de duplicación.
T. gondii se propaga dentro de estas vacuolas por una serie de divisiones binarias hasta que la célula infestada finalmente se rompe, liberando a los taquizoitos. Estos son motiles, y la forma de reproducción asexual del parásito. A diferencia de los bradizoitos, los taquizoitos libres son eficazmente eliminados por la inmunidad del hospedador o huésped, a pesar de que algunos logran infectar otras células formando, manteniendo así el ciclo de vida de este parásito.
Los quistes tisulares son ingeridos por el gato al alimentarse de un ratón infectado. Los quistes sobreviven el paso por el estómago del gato y los parásitos infectan las células epiteliales del intestino delgado en donde pasan por la reproducción sexual y la formación de ooquistes, que son liberados con las heces. Otros animales, incluyendo los humanos ingieren los ooquistes (al comer vegetales no lavados adecuadamente) o los quistes tisulares al comer carne cruda o cocida inapropiadamente. T. gondii puede infectar cualquier tipo de células del huésped, con excepción de los eritrocitos; lo anterior lo realiza mediante acción enzimática o dejándose fagocitar.[cita requerida]

Señalización entre estadios
Resumir
Contexto
El desarrollo de la toxoplasmosis encefálica ocurre debido a la transición de bradizoito (estadio latente) a taquizoito (estadio de rápida replicación) dentro del hospedero definitivo.[17]
La tasa de replicación de taquizoitos es más alta que la tasa de los bradizoitos y esto se debe a que tiene una serie de factores que aceleran su metabolismo.[18] Entre estos factores se encuentra la familia de Proteínas de Choque Térmico (Heat Shock Proteins, HSP), que contiene unas proteínas muy conservadas de bajo peso molecular 70kDa (HSP70) y que son un tipo de chaperonas ubicuas que tienen alto potencial inmunogénico.[19] Hasta hace poco, se creía que la función principal de este tipo de proteínas malplegadas era actuar como chaperonas intracelulares relacionadas con citoprotección luego de que las células fueran estresadas por estímulos externos. Sin embargo, ahora se sabe que las HSP70 no solamente funcionan como chaperonas, sino también como citoquinas (chaperoquinas) en el espacio extracelular.[20]
Se sabe que los HSP son importantes para la diferenciación del bradizoito ya que estudios en los que se hace Knockout a los genes hsp27, hsp70 y hsp90 se suprime la inducción de bradizoitos in vitro. Por otro lado, al utilizar potenciadores de expresión como indometacina, hay un incremento en la formación de bradizoitos.[20] Adicionalmente, en cultivos de médula ósea, los interferones gamma (IFN-ϒ) incrementaron la formación de bradizoitos debido a la producción de óxido nítrico (NO).[21] Además, se ha encontrado que las HSP de T. gondii (TgHSP70) son reconocidas por las células B del hospedero (mHSP70, ratón) a pesar de ser homólogas entre sí.[22] Luego la inducción de los bradizoitos se da tanto por estrés oxidativo y como consecuencia de la respuesta inmune del hospedero.
Otros descubrimientos que dan soporte a la idea de que los HSP70 están asociados a la diferenciación de los bradizoitos a taquizoitos es que en otros protozoos como Leishmania chagasi y Trypanosoma cruzi, el gen hsp70 se ha asociado a la capacidad de sobrevivir a estrés oxidativo y llevar la diferenciación de promastigotes a amastigotes.[23]
Se cree que dicha diferenciación es una respuesta al estrés causado por condiciones ambientales relacionadas con la respuesta inflamatoria del hospedero definitivo y que la respuesta al choque térmico se debe a la plasticidad metabólica del parásito durante la diferenciación.[24]
Historia
En 1908, Charles Nicolle y Louis Manceaux en Túnez demuestran la presencia del parásito en un roedor, conocido como el Ctenodactylus gundi; al mismo tiempo en Brasil, Alfonso Splendore lo encontró en conejos. Se le denominó Toxoplasma gondii por toxo (del griego toxon ‘arco’) por su forma arqueada;[25] y gondii por el ratón.
Transmisión de Toxoplasma gondii
Los humanos pueden adquirir la infección por Toxoplasma gondii a través de diferentes vías.[26] En primer lugar, horizontalmente a través de la ingestión oral de ooquistes provenientes del medio ambiente. Además, horizontalmente por la ingestión de bradiozitos presentes en carnes crudas de huéspedes intermedios. Por último, los taquiozitos pueden ser transmitidos verticalmente durante la lactancia materna o trasmitidos desde una madre infectada al feto durante el embarazo. Esto último ocurre frecuentemente en las madres que han sido infectadas por primera vez durante la gestación, esto puede provocar problemas en el desarrollo del feto y patologías como retraso psicomotriz, anormalidades hematológicas, pérdida auditiva y visual e incluso pueden provocar la muerte del feto.[27]
Toxoplasmosis
Resumir
Contexto
En individuos inmunocompetentes, la infección se presenta con síntomas suaves parecidos a los de la gripe común, o son completamente asintomáticos. En este tipo de pacientes, los síntomas severos más frecuentes son infecciones retinales y linfadenopatías, que normalmente están asociados a una infección congénita que se manifiesta de forma tardía.
En humanos inmunodeprimidos, puede actuar como patógeno oportunista, por ejemplo en enfermos de sida.[28]

Tratamiento
Se recomienda el empleo de pirimetamina y sulfonamidas, la primera actúa sobre la síntesis del ácido fólico y la segunda sobre la síntesis del ácido paraaminobenzoico (sobre taquizoitos, no en quistes).
Para la prevención de la toxoplasmosis congénita en mujeres embarazadas se recomienda la espiramicina, ya que es menos tóxica. Este medicamento evita que los taquizoitos pasen el lago placentario hacia el feto. El problema de la toxoplasmosis en el embarazo son las dificultades diagnósticas porque las técnicas del diagnóstico de la infección primaria en la mujer embarazada no son totalmente absolutas ni inequívocas. Los estudios serológicos no son totalmente exactos y técnicas consideradas de elección en el diagnóstico de la toxoplasmosis aguda como IgG de baja avidez obtiene resultados no definitivos en el 25 % de los casos (cribado serológico en la gestante).[29] Además, cuando ya se ha producido el diagnóstico, se ha producido ya la transmisión, llegando el tratamiento tarde para evitar esta transmisión.[30] Es tan indeterminado el diagnóstico y mayores los efectos secundarios de las actuaciones médicas en un diagnóstico indeterminado, así como ineficacia con el tratamiento farmacológico de evitar la transmisión al feto que se aboga por no realizar el screening serológico a toxoplasma a todas las embarazadas de manera sistemática. Si el parásito ya ha atravesado la placenta ya no es eficaz, aunque parece tener beneficio disminuyendo la carga parasitaria y por lo tanto disminuyendo la severidad de los síntomas en algunos casos.[31] En inmunodeficientes se recomienda la combinación de pirimetamina con sulfadiazina, pero dada la mayor posibilidad de los pacientes infectados con VIH de alergia a las sulfas, en ocasiones es necesario usar la combinación de pirimetamina con la clindamicina.
Cuadro clínico
La etapa aguda de las infestaciones por toxoplasmosis pueden ser asintomáticas, pero a menudo aparecen síntomas gripales que conllevan a estados latentes. La infección latente es también, por lo general, asintomática, pero en personas inmunosuprimidas (pacientes trasplantados o con ciertas infecciones), pueden mostrar síntomas, notablemente encefalitis, que puede ser mortal.
Varía dependiendo en qué trimestre del embarazo se adquiera el parásito.[32]
- 1.er trimestre: muy probablemente la muerte fetal intrauterino.
- 2.º trimestre: el bebé nace con malformaciones.
- 3.er trimestre: secuelas, afecciones graves del sistema nervioso central, hidrocefalia, se reproduce en las paredes de los ventriculos, hay peligro de que el tejido necrosado obstruya el acueducto de Silvio, calcificaciones cerebrales, aspecto de niño prematuro, hepatoesplenomegalia, ictericia, neumonitis, miocarditis.
La toxoplasmosis en embarazadas es rara vez sintomática pero puede provocar: linfadenopatía, fiebre, mialgia, malestar general, entre otras.
En los humanos, la infección crónica latente con T. gondii se ha relacionado previamente con la violencia autodirigida suicida, el rasgo de agresión e impulsividad y el trastorno bipolar.[33]
En cuanto a los efectos en humanos, la toxoplasmosis puede causar esquizofrenia.[34] El «sentido biológico» de esta infección tendría sentido cuando los humanos eran cazados por felinos, en este caso, la alteración del comportamiento promoviendo un comportamiento agresivo que llevara a la exclusión social del individuo, aumentaría las posibilidades de ser cazado por un felino.[35] De esta forma, el parásito podría llevar a cabo su ciclo vital reproductivo en su huésped definitivo.[36]
La infección está también relacionada con una mayor tasa de suicidio en pacientes infectados.[37] Esto podría estar relacionada con la alteración de la concentración de dopamina en partes específicas del cerebro que juegan un papel esencial en el comportamiento y emociones de los humanos.
Comportamiento animal
Las infecciones parásito-huésped son frecuentemente consideradas como un mecanismo evolutivo. Ambos, parásito y huésped desarrollan adaptaciones y contra-adaptaciones contra el otro, resultando en una coevolución antagonista.[38] Se ha observado que la infección por T. gondii tienen la facultad de cambiar el comportamiento de ratas y ratones, haciendo que se acerquen, en vez de huir del olor de los gatos. Este efecto es de beneficio para el parásito, el cual puede reproducirse sexualmente si es ingerido por el gato.[39] Un clásico ejemplo de manipulación del comportamiento son los grillos infectados por nematomorfos. Los mismos son manipulados para suicidarse saltando a cuerpos de agua cuando son infectados; de esta forma, el nematomorfo adulto es capaz de completar la fase reproductiva de su ciclo vital, que es acuática.[40]
La infección tiene una gran precisión, en el sentido de que no impacta los otros temores de la rata, tal como el temor de los espacios abiertos o del olor de alimentos desconocidos. Se ha especulado que el comportamiento humano puede igualmente verse afectado de algún modo, y se han encontrado correlaciones entre las infecciones latente por Toxoplasma y varias características, tales como un aumento en comportamientos de alto riesgo, tales como una lentitud para reaccionar, sentimientos de inseguridad y neurosis[41] que parece que aumentan la propensión al suicidio.[42]
Véase también
- AMA1, Antígeno Apical de Membrana.
Referencias
Enlaces externos
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
