Sulfuro de litio
compuesto químico De Wikipedia, la enciclopedia libre
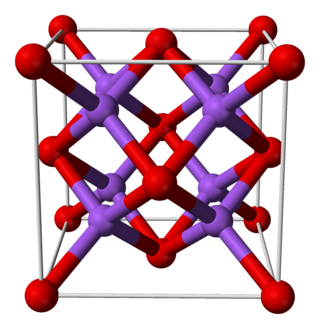
El sulfuro de litio es un compuesto inorgánico cuya fórmula es Li2S. Su estructura cristalina se corresponde con un modelo de estructura antifluorita, un modelo cúbico centrado en caras en el que el anión S2− ocupa los vértices y centros de las caras y el ion Li+ se sitúa en los huecos intersticiales. El aspecto físico es el de un sólido pulverulento deliquescente de color amarillento. En presencia de aire, se hidroliza fácilmente para desprender ácido sulfhídrico (olor a huevo podrido).[3]
| Sulfuro de litio | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Sulfuro de litio | ||
| General | ||
| Fórmula estructural |
 | |
| Fórmula molecular | Li2S | |
| Identificadores | ||
| Número CAS | 12136-58-2[1] | |
| Número RTECS | OJ6439500 | |
| ChemSpider | 8466196 | |
| PubChem | 10290727 | |
| UNII | SW6C51V9JZ | |
|
[Li+].[Li+].[S-2]
[Li+].[Li+].[S-2] | ||
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Densidad | 1660 kg/m³; 1,66 g/cm³ | |
| Masa molar | 45,95 g/mol | |
| Punto de fusión | 1211 K (938 °C) | |
| Punto de ebullición | 1645 K (1372 °C) | |
| Estructura cristalina | Fluorita | |
| Propiedades químicas | ||
| Solubilidad en agua | muy soluble | |
| Solubilidad | muy soluble en etanol | |
| Peligrosidad | ||
| NFPA 704 |
1
3
1
| |
| Riesgos | ||
| LD50 | 240 mg/kg (oral, ratas)[2] | |
| Compuestos relacionados | ||
| Otros aniones | Óxido de litio | |
| Otros cationes |
Sulfuro de sodio Sulfuro de potasio | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Preparación
El sulfuro de litio se obtiene mediante la reacción del litio con el azufre, la cual se lleva a cabo convenientemente en amoníaco anhidro.[4][5]
El aducto trietilborano del sulfuro de litio puede obtenerse usando superhidruro.[6]
Aplicaciones
El sulfuro de litio se ha considerado para ser utilizado en baterías de litio-sulfuro.[7]
Referencias
Wikiwand - on
Seamless Wikipedia browsing. On steroids.