Streptococcus pyogenes
especie de bacterias De Wikipedia, la enciclopedia libre
Streptococcus pyogenes o estreptococo beta-hemolítico del grupo A o estreptococo del grupo A (GAS por el acrónimo inglés de group A streptococcus), es una bacteria (por ello, es un organismo procariota) Gram-positiva que crece en cadenas de cuatro a diez células. En su pared celular expresa el antígeno grupo A de la clasificación de Lancefield y hace hemólisis del tipo beta-hemólisis cuando se cultiva en agar sangre, debido a las hemolisinas que produce (estreptolisina S y O).[1][2]
| Streptococcus pyogenes | ||
|---|---|---|
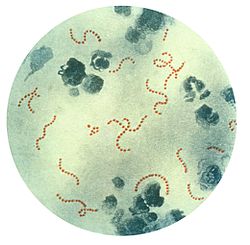 S. pyogenes bacteria @ 900x | ||
| Taxonomía | ||
| Dominio: | Bacteria | |
| Filo: | Bacillota | |
| Clase: | Bacilli | |
| Orden: | Lactobacillales | |
| Familia: | Streptococcaceae | |
| Género: | Streptococcus | |
| Especie: |
S. pyogenes Rosenbach 1884 | |
S. pyogenes es uno de los patógenos humanos más comunes, capaz de originar diversas enfermedades supurativas (de ahí, príon, pus) y no supurativas. Entre las supurativas, el S. pyogenes constituye la causa más frecuente de faringitis bacteriana, aunque también produce otitis media, mastitis, infecciones en las capas superficiales de la piel (impétigo), en las capas profundas (erisipela), y en los casos más severos, fascitis necrotizante, de donde proviene el apelativo «bacteria comedora de carne» de esta bacteria. Dentro de las no supurativas encontramos la fiebre reumática y la glomerulonefritis posestreptocócica.[1][3][4][5]
S. pyogenes típicamente produce grandes zonas (halo) de beta-hemólisis, con completa rotura de eritrocitos y la recuperación de hemoglobina, por todo ello se le conoce también por estreptococo beta-hemolítico del grupo A (o sus siglas en inglés: GAS). Puede ser encapsulado por lo que es resistente a la fagocitosis, posee numerosas exotoxinas. Se trata de un microorganismo no esporulado (no produce esporas).
S. pyogenes tiene un genoma de 1.8 - 1.9 Mpb. La secuencia completa del genoma de la cepa tipo (NCTC 8198T = CCUG 4207T) está disponible en el DNA Data Bank of Japan (DDBJ), European Nucleotide Archive (ENA) y GenBank bajo los n'umeros de acceso LN831034 y CP028841.[6]
Etimología
El nombre de Streptococcus pyogenes deriva de las siguientes raíces griegas:
- στρεπτός streptós: Flexible y no está completamente comprobado aún.
- κόκκος cóccos: Grano o baya
- πύον píon: Pus
- γεννάω gennáo: Engendrar o producir
Literalmente, un grano o baya flexible, en referencia al aspecto de las largas y flexibles cadenas de cocos, productor de pus, ya que se asocia a la formación de pus en las heridas.
Así mismo, el término MeSH lo define como:[7]
A species of gram-positive, coccoid bacteria isolated from skin lesions, blood, inflammatory exudates, and the upper respiratory tract of humans. It is a group A hemolytic Streptococcus that can cause SCARLET FEVER and RHEUMATIC FEVER.Una especie de cocobacterias gram-positivas, aisladas de lesiones de la piel, sangre, exudados inflamatorios, y el tracto respiratorio superior de los seres humanos. Se trata de un estreptococo hemolítico del grupo A que puede causar escarlatina y fiebre reumática.
Fisiología y estructura
Resumir
Contexto


Las cepas de S. pyogenes son cocos esféricos de diámetro comprendido entre 1 y 2 µm que forman cadenas cortas en las muestras clínicas y cadenas de mayor longitud cuando crecen en medios de cultivo. Su crecimiento se ve favorecido en el agar sangre enriquecido pero se ve inhibido cuando contiene una concentración elevada de glucosa. Después de 24 horas de crecimiento se observa β-hemólisis.[4]
Pared celular
La pared celular de esta bacteria está constituida por una capa de peptidoglucano gruesa que la clasifica dentro del grupo de bacterias grampositivas. En la pared celular se encuentran los antígenos específicos de grupo y de tipo. El carbohidrato específico de grupo representa el 10% del peso en seco de la célula. Para esta bacteria se expresa el antígeno específico A del grupo de Lancefield, un dímero de N-acetilglucosamina y de ramnosa.[4][8][9]
Proteína M
La proteína M es la proteína principal de la superficie del estreptococo y está asociada a la virulencia del GAS; está codificada por el gen emm. La proteína M se usa para serotipar a las cepas de S. pyogenes.
La proteína M es similar a la tropomiosina; se compone de dos cadenas polipeptídicas que forman una alfa hélice central flanqueada por dominios funcionales terminales. La hélice central tiene cuatro bloques con repeticiones, de la A a la D desde el N-terminal hacia el C-terminal, donde los bloques A y B se proyectan hacia la matriz extracelular, dándole la especificidad al serotipo; y el bloque D se encuentra adyacente a la zona de anclaje en el peptidoglucano de la pared celular.[10]
La proteína M protege a la bacteria de la fagocitosis al unirse al factor H (proteína reguladora del complemento) y fibrinógeno, y favorece la degradación del factor del complemento C3b. Esta se encuentra anclada por el grupo carboxilo a la membrana citoplasmática y, por una secuencia altamente conservada, se extiende a través de la pared celular.[4][8]
Las proteínas M se subdividen en dos tipos, moléculas de clase I y moléculas de clase II, las bacterias portadoras de la proteína M clase I están asociadas con fiebre reumática. La proteína M está codificada por el gen emm.[4] La respuesta inmune hacia la proteína M es un arma de dos filos para el huésped, ya que por una parte induce la producción de anticuerpos protectores que promueven la fagocitosis. Sin embargo, estos anticuerpos pueden reaccionar con estructuras localizadas en los tejidos del huésped.[8]
Cápsula
En la estructura de la bacteria destacan la presencia de una cápsula de ácido hialurónico, producida por la mayoría de las células, es de gran importancia ya que es imposible diferenciarla a nivel antigénico del ácido hialurónico presente en el tejido conjuntivo del mamífero —de manera comparable con una capa de invisibilidad—. Las cepas encapsuladas son las responsables de las infecciones sistémicas graves.[4][8]
Otros componentes
Entre otros componentes que conforman la estructura bacteriana se encuentran:[4][8]
- Superfamilia de genes emm (gen emm):La superfamilia de genes emm constan de un grupo de más de 20 genes que codifican las proteínas M, las proteínas tipo M y otras proteínas que se unen a las inmunoglobulinas (Ig).
- Proteínas tipo M. Estas están codificadas por el gen emm
- Ácido lipoteicóico y proteína F: El ácido lipoteicóico y la proteína F facilitan la unión a las células del hospedero, ya que pueden formar un complejo con la fibronectina.
Factores de virulencia
Resumir
Contexto

S. pyogenes tiene varios atributos que lo hacen más virulento, incrementando su habilidad para colonizar, multiplicarse, evadir la respuesta inmune del huésped, y extenderse en el organismo.[5][11]
Cápsula de ácido hialurónico
Una cápsula de ácido hialurónico, un carbohidrato polisacarídico, envuelve la bacteria; no es antigénica dada su similitud con el tejido conectivo del huésped, y evita la opsonización al ocultar sus propios antígenos.[5] Además, hay ácidos lipoteicoicos y proteínas que embeben la cápsula (M proteína) que también incrementan la virulencia por facilitar la adherencia y la invasión de las células huésped.[12] La proteína M inhibe una parte del sistema inmune: el sistema del complemento, que participa en la identificación y destrucción de las bacterias invasoras. Sin embargo, la proteína M es también un punto débil en el mecanismo de defensa porque es un patrón en la producción de anticuerpos del sistema inmune del hospedador, usado para reconocer las bacterias. Las proteínas M son únicas en cada cepa y su identificación puede usarse clínicamente para confirmar el germen causante de una infección.
Hay varias toxinas y enzimas que contribuyen a la virulencia de S. pyogenes:
Estreptolisina O y S
- Tóxinas que son la base de las propiedades beta-hemolíticas del organismo. La estreptolisina O causa una respuesta inmune y la detección de anticuerpos en el suero sanguíneo; la antiestreptolisina O (ASLO) puede usarse clínicamente para confirmar una reciente infección.
- La estreptolisina S es una hemolisina adherida a la célula y estable frente al oxígeno, no es inmunogénica, es capaz de lisar eritrocitos, así como leucocitos y plaquetas tras contacto directo.
Toxina Pirogénica
- Encontrada en las cepas de S. pyogenes responsables de la fiebre escarlatina y en las responsables del síndrome de shock tóxico estreptocócico. El gen de la toxina es proporcionado por un fago lisogénico.
Estreptoquinasa
- La estreptoquinasa activa enzimáticamente al plasminógeno, una enzima proteolítica plasmática que digiere a la fibrina (proteína que forma los coágulos) y otras proteínas.
Hialuronidasa
- La hialuronidasa rompe el ácido hialurónico, un importante componente del tejido conectivo, facilitando la expansión de la infección.
Estreptodornasa
- Una ADNasa, la estreptodornasa despolimeriza el ADN. El huésped produce anticuerpos contra esta enzima, que pueden ser utilizados para el diagnóstico serológicos de las infecciones por Streptococcus pyogenes.
Otras toxinas
- Incluye la peptidasa anti-C5a y otras.
La identificación definitiva del Streptococcus pyogenes se realiza por la demostración del antígeno específico de grupo A en la cepa aislada mediante la técnica de coaglutinación.
Patogénesis

S. pyogenes se asocia a muchas enfermedades, algunas muy importantes: faringitis estreptocócica, infecciones de piel por estreptococo (celulitis, erisipelas, impétigos, fascitis necrotizante). La faringitis se puede complicar con la aparición de un exantema difuso (escarlatina), lo que ocurre con algunas cepas de estreptococo. Otras enfermedades que puede causar son la bartolinitis y síndrome de shock tóxico por estreptococo. También puede causar enfermedad a través de la reacción del sistema inmune, como en la fiebre reumática y la glomerulonefritis postestreptocócica.
En Chile, en el primer trimestre de 2024, esta bacteria (denominada bacteria asesina) asociada al brote de influenza ha producido con 191 casos y 6 fallecimientos, elevadas tasas de infección con tasas de mortalidad infrecuentes. [13] [14]
Cuadro clínico
Resumir
Contexto
Infecciones por Streptococcus pyogenes:

- Infecciones supurativas
- Faringitis: Es una infección de la faringe, la cual se encuentra enrojecida y con presencia frecuente de exudados y linfadenopatía cervical, misma que puede ser prominente
- Escarlatina: Es un exantema eritematoso difuso que comienza en el tórax y se extiende posteriormente a las extremidades, suele ser una complicación de la faringitis estreptocócica
- Pioderma: Es una infección cutánea localizada con vesículas que avanzan a pústulas sin indicios de enfermedad sistémica.
- Erisipela: Es una infección cutánea con dolor, inflamación, adenopatía y síntomas sistémicos
- Celulitis: Infección cutánea que afecta a los tejidos subcutáneos
- Fascitis necrosante:Es una infección de la piel que provoca la destrucción del tejido adiposo y tejido muscular subyacente.
- Síndrome del shock tóxico estreptocócico:Es una infección sistémica, semejante al síndrome del shock tóxico estafilocócico provocado por Staphylococcus aureus. Los pacientes suelen presentar bacteriemia e indicios de fascitis.
- Otras enfermedades supurativas: Entre estas se encuentran la septicemia puerperal, la linfangitis y la neumonía
- Infecciones no supurativas
- Fiebre reumática: Se caracteriza por alteraciones inflamatorias del corazón (pericarditis), articulaciones (desde altralgias hasta artritis), vasos sanguíneos y tejidos subcutaneos. Este daño está mediado por mimetismo molecular y generación de anticuerpos dirigidos contra el anfitrión (enfermedad autoinmune).
- Glomerulonefritis aguda: Es la inflamación aguda de los glomérulos renales con edema, hipertensión, hematuria y proteinúria.
Diagnóstico de laboratorio
Resumir
Contexto

Microscopía
La observación de una muestra al microscopio teñida con Gram es útil para realizar un diagnóstico rápido y preliminar con el fin de iniciar un tratamiento oportuno. Suelen verse como cocos grampositivos agrupados en cadenas asociados con leucocitos es relevante ya que los estreptococos no suelen colonizar la superficie cutánea; no obstante, Streptococcus pyogenes es parte de la microbiota normal de la orofaringe y debería tenerse a consideración si esta muestra es aislada de la orofaringe porque el pronóstico se ve fuertemente sesgado.[4]
Detección de antígenos
Mediante el uso de pruebas inmunológicas que utilizan anticuerpos que reaccionan con los carbohidratos específicos de grupo (en este caso, antígeno A) puede identificarse a esta bacteria en frotis sanguíneo o de manera directa. Estas pruebas poseen una sensibilidad moderada y especificidad alta, además de ser económicas.[4]
Pruebas para ácidos nucleicos
Las pruebas para ácido nucleico incluyen sondas (sensibilidad baja, especificidad alta) y pruebas de reacción en cadena de la polimerasa (PCR, sensibilidad alta, especificidad altísima) suelen ser útiles en muestras faríngeas pero el PCR no está al alcance de hospitales aún.[4]
Cultivo
|
Los cultivos de esta bacteria suelen hacerse con muestras de la faringe posterior ya que aumenta la probabilidad de aislar la bacteria porque se encuentra mayor cantidad de saliva y otras bacterias que inhiben el crecimiento de S. pyogenes, y de piel, aunque esta tiende a contaminarse por Staphylococcus. También pueden realizarse cultivos tisulares y hemocultivos procedentes de pacientes con fascitis necrosante. Para mejorar la sensibilidad de las pruebas aisladas de la boca puede añadirse antibióticos a la placa o usar placas diferenciales (que ya incluyen antibióticos) aunque el crecimiento es más lento.[4]
Identificación
Streptococcus pyogenes se identifican de forma definitiva mediante la demostración del antígeno A (carbohidrato del grupo), su susceptibilidad hacia bacitracina o por la presencia de su enzima L-pirrolidonil-arilamidasa (PYR). La prueba de PYR es una prueba muy rápida (1 minuto aprox.) y mide la hidrólisis de L-pirrolidonil-β-naftilamida, que en presencia de p-dimetilaminocinnamaldehido, formando un compuesto rojo.[4]
Detección de anticuerpos
Los pacientes con enfermedad por S. pyogenes generan anticuerpos frente a varias enzimas específicas, principalmente los anticuerpos dirigidos contra la estreptolisina O y la proteína M. Los anticuerpos contra la estreptolisina O aparecen tempranamente (entre 3 y 4 semanas) y pueden ser detectados con la prueba ASLO (Anti-StreptoLysin-O) que es útil para confirmar el diagnóstico de fiebre reumática o glomerulonefritis aguda derivadas de una infección estreptocócica reciente. Los sujetos con piodermitis desarrollan pocos anticuerpos contra estreptolisina-O, pero, al igual que en la faringitis, se desarrollan títulos contra ADNasa B, que pueden ser detectados con la prueba de la anti-ADNasa B.[4] Se puede dar un diagnóstico diferencial entre este y la fiebre de Zika.[15]
Diagnóstico diferencial
Se puede dar un diagnóstico diferencial entre Grupo A streptococcus pyogenes y la fiebre de Zika.[15]
Tratamiento
S. pyogenes es altamente sensible a penicilina. En los pacientes alérgicos a esta puede usarse eritromicina o una cefalosporina oral, pero este tratamiento suele ser ineficaz contra infecciones mixtas con staphylococcus aureus, en donde el tratamiento puede incluir oxacilina o vancomicina.[4] La azitromicina y claritromicina (macrólidos) no han demostrado ser más eficaces que eritromicina (otro macrólido).[16] En sujetos con compromiso severo de los tejidos blandos debe iniciarse el desbridamiento o drenaje quirúrgico.
El tratamiento antibiótico de los pacientes con faringitis acelera la recuperación de los síntomas y previene la fiebre reumática cuando se instaura durante los primeros 10 días del inicio de la enfermedad. No parece que el tratamiento inhiba la progresión de la glomerulonefritis aguda.[16][4]
Vacuna
Existe una vacuna del tipo inactivada polivalente que cubre varios tipos de Streptococcus, incluido el pyogenes denominada vacuna antipiogena polivalente BIOL y se recomienda su administración en una serie de 5 semanas. Se realizan 2 aplicaciones semanales en intervalos de 2 a 4 días. La vacuna es elaborada por el Instituto Biológico Argentino.[17]
Inmunoterapia para el cáncer
En 1866, el médico alemán W. Bush observó casos de sarcoma desapareciendo luego de una infección de erisipelas. En 1882, otro médico alemán, Fehleisen, identifico el patógeno causante. Ambos infectaron a sus pacientes a propósito, causando la regresión del tumor en un gran porcentaje de los casos. En 1891, el cirujano de huesos William Coley, luego de perder a una paciente por un osteosarcoma, a pesar de haberla intervenido quirurgicamente, reviso la literatura para buscar si habían habido casos de supervivencia. Notando que la mayoría de casos donde el paciente se había curado habían tenido una infección por erisipelas al momento de hacerlo, se propuso buscar a uno de los pacientes, de nombre Stein para comprobar si este se encontraba con vida luego de más de una década. Lo encontró y sin rastros de enfermedad. Tras esto, Coley empezó a tratar a sus pacientes infectándolos con esta bacteria. Dos pacientes murieron, por lo que se volcó a usar en su lugar, una versión inactivada por calor, mezclada con la bacteria Serratia marscecen, que luego pasaría a conocerse como "toxinas de Coley". Coley reportó supervivencias a 5 años de 51 % promediando varios tipos de cáncer, una tasa no superada hasta los años 70. En 1962, la FDA prohibió su uso en la práctica media, limitándola a tratamientos experimentales.[18][19]
Referencias
Wikiwand - on
Seamless Wikipedia browsing. On steroids.


