Top Qs
Línea de tiempo
Chat
Contexto
Ley de Boyle-Mariotte
leyes de los gases que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante De Wikipedia, la enciclopedia libre
Remove ads
Remove ads
La ley de Boyle Mariotte (ley de Boyle) es una de las leyes de los gases que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante.
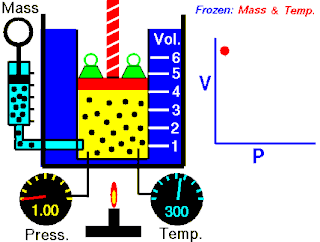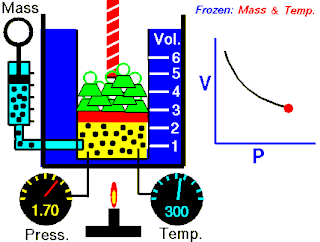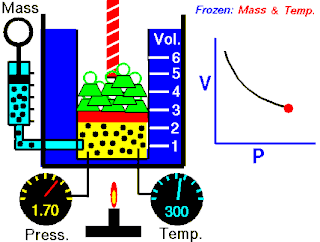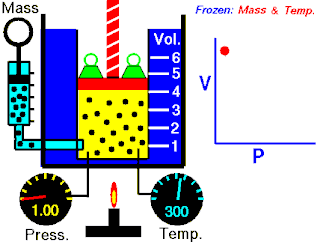
La ley de Boyle expresa que:
La presión absoluta ejercida por una dada masa de un gas ideal es inversamente proporcional al volumen que ocupa si la temperatura y la cantidad de gas permanecen invariables dentro de un sistema cerrado.[1][2]
Matemáticamente, la ley de Boyle puede expresarse como:
| La presión es inversamente proporcional al volumen |
o
| PV = k | El producto de la presión y el volumen es un número constante (aqui indicado como k) |
donde P es la presión del gas, V es el volumen del gas, y k es una constante para una dada temperatura y cantidad de gas.
La ley de Boyle establece que cuando la temperatura de una masa dada de gas confinado es constante, el producto de su presión y volumen también es constante. Cuando se compara la misma sustancia bajo dos conjuntos diferentes de condiciones, la ley puede expresarse como:
que muestra que a medida que aumenta el volumen, la presión de un gas disminuye proporcionalmente, y viceversa.
La ley de Boyle-Mariotte fue formulada independientemente por el físico y químico irlandés Robert Boyle en 1662 y el físico y botánico francés Edme Mariotte en 1676.[3]
Remove ads
Historia
Resumir
Contexto

Esta relación entre presión y volumen fue notada por primera vez por Richard Towneley y Henry Power en el siglo XVII.[4][5] Robert Boyle confirmó su descubrimiento a través de experimentos y publicó los resultados.[6] Según Robert Gunther y otras autoridades, fue el asistente de Boyle, Robert Hooke, quien construyó el aparato experimental. La ley de Boyle se basa en experimentos con aire, al que consideraba un fluido de partículas en reposo entre pequeños resortes invisibles. En ese momento, el aire todavía se consideraba uno de los cuatro elementos, pero Boyle no estaba de acuerdo. Probablemente el interés de Boyle fue entender el aire como un elemento esencial de la vida;[7] por ejemplo, publicó trabajos sobre el crecimiento de las plantas sin aire.[8] Boyle usó un tubo cerrado en forma de J y, después de verter mercurio por un lado, obligó al aire del otro lado a contraerse bajo la presión del mercurio. Después de repetir el experimento varias veces y utilizando diferentes cantidades de mercurio, descubrió que, en condiciones controladas, la presión de un gas es inversamente proporcional al volumen que ocupa.[9] El físico francés Edme Mariotte (1620–1684) descubrió la misma ley independientemente de Boyle en 1679,[10] pero Boyle ya lo había publicado en 1662.[9] Sin embargo, Mariotte descubrió que el volumen del aire cambia con la temperatura.[11] Por lo tanto, esta ley a veces se denomina ley de Mariotte o ley de Boyle-Mariotte. Más tarde, en 1687 en el Philosophiæ Naturalis Principia Mathematica, Newton demostró matemáticamente que en un fluido elástico formado por partículas en reposo, entre las que se encuentran fuerzas de repulsión inversamente proporcionales a su distancia, la densidad sería directamente proporcional a la presión,[12] pero este tratado matemático no es la explicación física de la relación observada. En lugar de una teoría estática, se necesita una teoría cinética, que fue proporcionada dos siglos más tarde por Maxwell y Boltzmann.
Esta ley fue la primera ley física que se expresó en forma de ecuación que describía la dependencia de dos cantidades variables.[9]
Remove ads
Simbología
Remove ads
Definición
Resumir
Contexto
La propia ley puede enunciarse de la siguiente manera:
Para un gas a temperatura constante, el volumen es inversamente proporcional a la presión sobre éste.[2]

Se puede explicar matemáticamente con:
Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye, el volumen aumenta.
La ley de Boyle es una ley de los gases, que establece que la presión y el volumen de un gas tienen una relación inversa. Si el volumen aumenta, entonces la presión disminuye y viceversa, cuando la temperatura se mantiene constante.
Por lo tanto, cuando el volumen se reduce a la mitad, la presión se duplica; y si el volumen se duplica, la presión se reduce a la mitad.
No es necesario conocer el valor exacto de la constante () para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
Además, si se despeja cualquier incógnita se obtiene lo siguiente:
| 1 | ||||
|---|---|---|---|---|
| Ecuaciones | ||||
| Despejando | ||||
También conocido como la regla de tres.
Esta ley es una simplificación de la Ley de los gases ideales particularizada para procesos isotérmicos de una cierta masa de gas constante.
Junto con la ley de Charles, la ley de Gay-Lussac, la ley de Avogadro y la ley de Graham, la ley de Boyle forma las leyes de los gases, que describen la conducta de un gas ideal. Las tres primeras leyes pueden ser generalizadas en la ley de los gases ideales.
Remove ads
Experimento de Boyle
Resumir
Contexto
Esta teoría explicaba que los átomos y moléculas, en el estado gaseoso, se comportan como centros puntuales de masa que sólo en el rango de las altas presiones y bajas temperaturas son afectadas por las fuerzas atractivas. Fuera de estos límites, las propiedades físicas de un gas se deben principalmente al movimiento independiente de sus moléculas.
Si se considera a un gas contenido en un recipiente, la presión que este ejerce es la fuerza por unidad de área sobre las paredes debida a los impactos elásticos de las moléculas.
Robert Boyle descubrió en 1662 la relación matemática entre la presión y el volumen de una cantidad fija de gas a temperatura constante. Según la ley de Boyle, el volumen de una masa dada de gas varía en forma inversamente proporcional a la presión cuando la temperatura se mantiene en un valor fijo. La expresión matemática de la ley se escribe:
(proceso isotérmico) (12.1)
La magnitud de la constante k es función de la cantidad química de gas y de la temperatura.
Para dos estados diferentes 1 y 2, la ley implica:
(12.2)
Es decir, si se explora el comportamiento físico de un gas de acuerdo con la ley de Boyle y asumiendo comportamiento ideal, se puede concluir que, a temperatura constante:
Si se duplica la presión sobre una masa dada de gas, su volumen se reduce a la mitad. Si el volumen de una masa dada de gas se triplica, la presión se reduce en un tercio.
Es usual en los experimentos sobre la ley de Boyle obtener un conjunto de datos de presión y volumen, los cuales se pueden representar gráficamente para obtener el valor de (). Un gráfico de () versus () (figura 13.1) da como resultado la hipérbola característica que corresponde a la ecuación 13.1. Si se repite el experimento a temperaturas diferentes se genera una familia de hipérbolas, y debido a que la temperatura es constante a lo largo de cada línea, éstas curvas se denominan isotermas.
Para poder verificar su teoría, Mariotte introdujo un gas en un cilindro con un émbolo y comprobó las distintas presiones al bajar el émbolo.[14] A continuación hay una tabla que muestra algunos de los resultados obtenidos en este fenómeno siendo así:
Si se observan los datos de la tabla se puede comprobar que al aumentar la presión, el volumen disminuye. Por ello se usa una diagonal isotérmica para representarlo en una gráfica. () aumenta y que al multiplicar () y () se obtiene .
Remove ads
Sistema de respiración humana
La ley de Boyle se usa a menudo como parte de una explicación sobre cómo funciona el sistema de respiración en el cuerpo humano. Esto comúnmente implica explicar cómo el volumen pulmonar puede aumentar o disminuir y, por lo tanto, causar una presión de aire relativamente más baja o más alta dentro de ellos (de acuerdo con la ley de Boyle). Esto forma una diferencia de presión entre el aire dentro de los pulmones y la presión del aire ambiental, que a su vez precipita la inhalación o la exhalación a medida que el aire se mueve de alta a baja presión.[15]
Remove ads
Véase también
Referencias
Bibliografía
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads



 ,
,  ...
...












