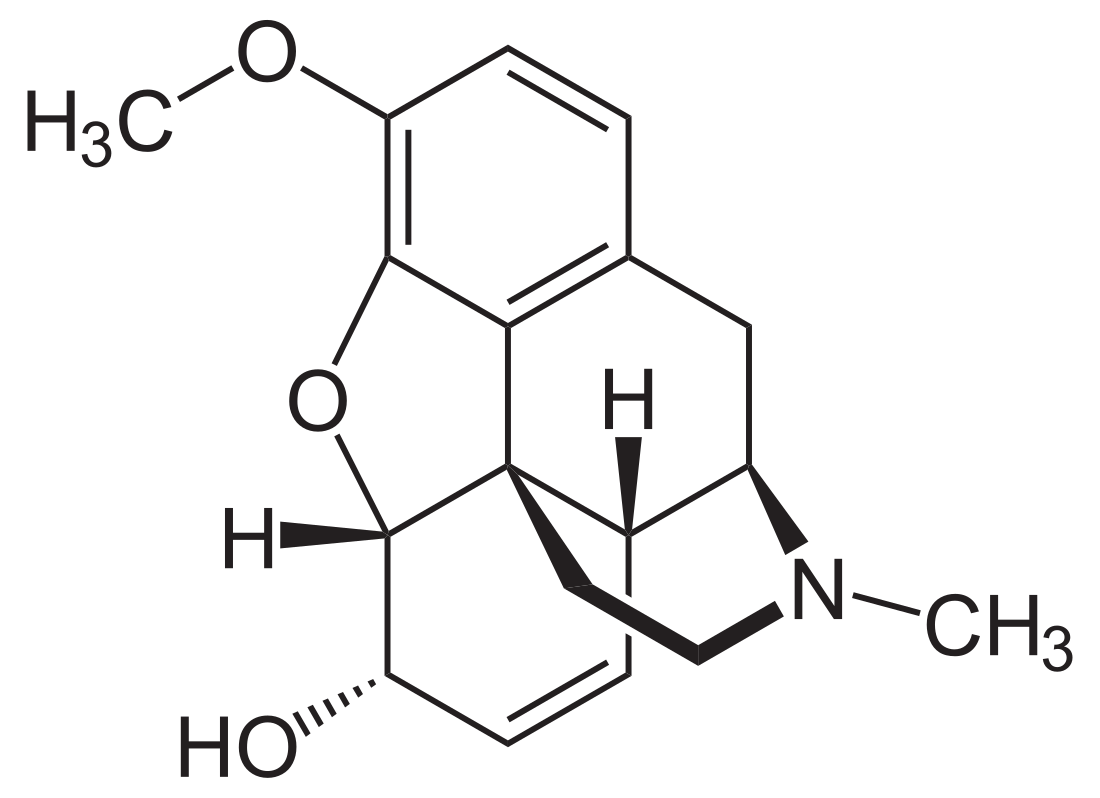
Codeína
compuesto químico De Wikipedia, la enciclopedia libre
La codeína es un fármaco opiáceo que se prescribe en el tratamiento del dolor (analgésico) y la tos (antitusígeno). Se encuentra naturalmente en la savia de la adormidera o amapola, (Papaver somniferum).
| Codeína | ||
|---|---|---|
 | ||
 | ||
| Nombre (IUPAC) sistemático | ||
|
(5α,6α)-7,8-didehidro-4,5-epoxi- 3-metoxi-17-metilmorfinan-6-ol | ||
| Identificadores | ||
| Número CAS | 76-57-3 | |
| Código ATC | R05DA04 | |
| PubChem | 5284371 | |
| DrugBank | DB00318 | |
| ChemSpider | 4447447 | |
| UNII | UX6OWY2V7J | |
| KEGG | C06174 | |
| ChEBI | 16714 | |
| ChEMBL | ChEMBL485 | |
| Datos químicos | ||
| Fórmula | C18H21NO3 | |
| Farmacocinética | ||
| Biodisponibilidad | ~90 % oral | |
| Datos clínicos | ||
| Estado legal | Grupo I ℞-Receta especial requerida (MEX) Grupo I ℞-Receta especial requerida (MEX), Grupo 2 opioide no sometido a control especial (COL) | |
| Vías de adm. |
Oral Parenteral | |
Se metaboliza en morfina en el hígado, pero debido a la baja velocidad de transformación, es mucho menos efectiva como analgésico y sedante que la morfina. Por lo anterior, se puede obtener un mayor beneficio cuando se combina con paracetamol (acetaminofeno) o un medicamento antiinflamatorio no esteroideo (AINE), como aspirina o ibuprofeno. La evidencia no respalda su uso para la supresión de la tos aguda en niños. En Europa, no se recomienda como medicamento para la tos en menores de doce años.
Se toma por vía oral en forma de comprimidos o jarabe. Por lo general, comienza a actuar después de media hora, con un efecto máximo a las dos horas. Sus efectos duran entre cuatro y seis horas. La codeína presenta un potencial de abuso similar al de otros medicamentos opioides, incluido el riesgo de habituación y sobredosis.
Los efectos secundarios comunes incluyen vómitos, estreñimiento, picazón, aturdimiento y somnolencia. Los efectos secundarios graves pueden incluir dificultades respiratorias y adicción. No está claro si su uso durante el embarazo es seguro. Se debe tener cuidado durante la lactancia, ya que puede provocar toxicidad por opiáceos en el bebé. Su uso a partir de 2016 no se recomienda en niños.
Historia
Resumir
Contexto
La codeína es un alcaloide que se encuentra en la amapola, Papaver somniferum esta se ha cultivado y utilizado a lo largo de la historia de la humanidad por sus propiedades medicinales (analgésicas y antitusivas) e hipnóticas relacionadas con la diversidad de sus componentes activos, que incluyen morfina, codeína y papaverina.
El nombre codeína se deriva del griego antiguo κώδεια (kṓdeia , ‘cabeza de amapola’). La proporción relativa de codeína y morfina, el alcaloide del opio más común, entre el 4 % y el 23 %, tiende a ser algo mayor en el método de la paja de adormidera para preparar los alcaloides del opio.
Hasta principios del siglo XIX, el opio crudo se utilizaba en diversas preparaciones conocidas como láudano y en elixires paregóricos, algunos de los cuales fueron populares en Inglaterra desde el principio del siglo XVIII; la preparación original parece haber sido elaborada en Leiden, Países Bajos, alrededor de 1715 por el químico Jakob Le Mort. En 1721 la Farmacopea de Londres menciona un Elixir Asthmaticum, reemplazado por el término Elixir Paregoricum («calmante del dolor») en 1746.

La codeína fue aislada por primera vez en 1832 en Francia por Pierre Robiquet, ya famoso por el descubrimiento de la alizarina, el colorante rojo más difundido, mientras trabajaba en los procesos de extracción refinada de la morfina. A Robiquet también se le atribuye el descubrimiento de la cafeína.
Thomas Anderson determinó la composición correcta en 1853, pero John Masson Gulland y Robert Robinson propusieron una estructura química como tal, recién en 1925. Por otro lado, la codeína y la morfina, así como el opio, se utilizaron en un intento de tratar la diabetes en la década de 1880 y posteriormente, en fechas tan recientes como la de 1950. La primera estructura cristalina tendría que esperar hasta 1954.
Farmacocinética
Resumir
Contexto
Vías de administración
Se administra por vía enteral, vía oral y en algunos casos por vía parenteral.
Absorción
La codeína y sus sales se absorben en el tracto gastrointestinal, el inicio de su efecto es alrededor de treinta minutos, alcanzando concentraciones plasmáticas máximas aproximadamente una hora posterior a su administración, que persisten entre tres y cuatro horas después de una dosis oral o intramuscular. Su biodisponibilidad es del 90 %. 3
Distribución
Se distribuye ampliamente con preferencia hacia los órganos parenquimatosos como el hígado, bazo y riñón. Con un volumen de distribución de 3-6 L/kg. Tiene una baja unión a las proteínas plasmáticas (7-25 %) y no se acumula en los tejidos corporales. La codeína atraviesa la barrera hematoencefálica y se encuentra en los tejidos fetales y en la leche materna. 2 3
Metabolismo y metabolitos
Se metaboliza en el hígado, mediante conjugación con ácido glucurónico a codeína-6 glucurónido (C6G), por O-desmetilación a morfina (aproximadamente 5-10 %) y N-desmetilación a norcodeína ( alrededor del 10 %) respectivamente. La UDP-glucuronosiltransferasa (UGT) 2B7 y 2B4 son las principales enzimas metabólicas que median la glucurodinación de la codeína al metabolito C6G.
El citocromo P450 2D6 es la principal enzima responsable de la transformación de codeína en morfina y la P450 3A4 es la principal enzima que media en la conversión de codeína en norcodeína. Luego, la morfina y la norcodeína se metabolizan aún más mediante conjugación con ácido glucurónico. Los metabolitos glucurónidos de la morfina son morfina-3-glucurónido (M3G) y morfina-6-glucurónido (M6G). 3
Diferencia estructural entre codeína y morfina

La principal diferencia estructural entre la codeína y la morfina es la presencia de un grupo metoxilo (-OCH₃, círculo rojo) en la codeína en lugar del grupo hidroxilo (-OH, círculo azul) que se encuentra en la morfina en el carbono 3. Esta diferencia afecta la forma en que el cuerpo metaboliza cada compuesto. Además, se ve en imagen la enzima encargada de convertir la codeína en morfina, CYP2D6, mediante una O-desmetilación. 3
Excreción
La codeína se excreta en un 90 % por los riñones, y su semivida de eliminación es de aproximadamente 3-4 horas. Los productos excretados por la orina consisten en codeína libre y en su derivado glucurónido-conjugado (alrededor del 70 %), norcodeína libre y conjugada (alrededor del 10 %), morfinalibre y conjugada (alrededor del 10 %), normorfina (4 %) e hidrocodona (1 %). El resto de la dosis se excreta por las heces. ²
Farmacodinámica
Resumir
Contexto

Mecanismo de Acción
La codeína es un opioide que se convierte en morfina en el cuerpo, principalmente a través de la acción de la enzima CYP2D6. Actúa como un agonista parcial de los receptores mu-opioides (μ), κ (kappa) y δ (delta) en el sistema nervioso central. La unión a estos receptores inhibe la transmisión de señales de dolor y modifica la percepción del dolor.
Mecanismos indirectos
Los opioides, dependiendo de la dosis, reducen la liberación de acetilcolina en varias áreas del cerebro, incluidos el hipocampo, cuerpo estriado y la corteza cerebral. El mecanismo tiene que ver con la entrada de Ca2 +, y no con mecanismos GABAérgicos.
Por otro lado, la liberación central de monoaminas está influenciada por los opioides. De hecho, se sabe que los mecanismos analgésicos de los opioides dependen de proyecciones descendentes de monoaminas. Los agonistas opioides de los receptores μ, κ y δ inhiben la liberación de norepinefrina en el hipotálamo y corteza. Este efecto está mediado por receptores μ ubicados en neuronas noradrenérgicas. Las proyecciones corticales de serotonina, por el contrario, no se ven afectadas por los opioides.
En general, los agonistas μ aumentan la transmisión en el sistema mesolímbico dopaminérgico. Inhiben las neuronas GABAérgicas en el área tegmental ventral, desinhibiendo la actividad de la dopamina. Por el contrario, los agonistas κ inhiben la liberación de dopamina en el mismo sistema. Al igual que con otras drogas de abuso, se cree que una influencia sobre la dopamina mesolímbica media los efectos de refuerzo de los opioides.
Efectos farmacológicos
- Analgesia: La principal aplicación de la codeína es como analgésico para el alivio del dolor leve a moderado. Además de reducir el aspecto sensorial del dolor, los opioides pueden alterar el aspecto emocional, donde el dolor está presente, pero no causa tanto problema.
- Antitusivo: La codeína también se usa como supresor de la tos debido a su efecto depresor en el centro de la tos en el cerebro. Irónicamente, la heroína se desarrolló como medicamento para la tos con la esperanza de que tuviera efectos menos tóxicos y adictivos.
- Efectos en el sistema gastrointestinal
- Los agonistas del sistema digestivo disminuyen la secreción de ácido del estómago, reducen la -motilidad gástrica y prolongan el vaciado gástrico. Se reducen las secreciones pancreáticas, biliares e intestinales. Los movimientos peristálticos se reducen, pero el tono aumenta, lo que a veces provoca espasmos.
- Los opioides también aumentan la presión de los conductos biliares. La codeína también provoca náuseas y vómitos por estimulación del área postrema.
- Los agonistas del sistema digestivo disminuyen la secreción de ácido del estómago, reducen la -motilidad gástrica y prolongan el vaciado gástrico. Se reducen las secreciones pancreáticas, biliares e intestinales. Los movimientos peristálticos se reducen, pero el tono aumenta, lo que a veces provoca espasmos.
- Efectos en el sistema cardiovascular: La codeína no tiene efectos cardiovasculares significativos si la persona está en decúbito supino, pero puede producirse hipotensión ortostática debido a la vasodilatación periférica y la inhibición de los reflejos barorreceptores. Los efectos miocárdicos no son significativos en individuos normales, pero pueden ser más variables durante el infarto de miocardio.
- Miosis: La codeína causa constricción de la pupila por una acción directa sobre el nervio parasimpático. La miosis es patognomónica de la sobredosis de opioides (específicamente agonistas μ), pero la midriasis ocurre con supresión respiratoria y asfixia.
- Efectos en el sistema respiratorio: Los ligandos respiratorios μ y δ participan en la regulación de la respiración. La supresión respiratoria es una característica habitual de la codeína, que suprime todas las fases de la respiración. El paro respiratorio no es una causa de muerte común en la población general, pero sí se restringe su uso en niños menores a 2 años porque en esa población hay probabilidad de muerte. Sin embargo, en dosis terapéuticas normales, los efectos respiratorios no son problemáticos en personas sin enfermedad pulmonar. La depresión respiratoria resulta de la alteración de la respuesta de las áreas del tronco del encéfalo a los niveles de dióxido de carbono.
- Efectos neuroendocrinos: A través de acciones hipotalámicas, la codeína inhibe la liberación de la hormona liberadora de gonadotropina y de la hormona liberadora de corticotropina. En consecuencia, hay una disminución de los niveles circulantes de la hormona luteinizante, la hormona folículo estimulante, la hormona adrenocorticotrópica, la b-endorfina, la testosterona y el cortisol. Se producen niveles elevados de prolactina, posiblemente a través de interacciones con sistemas dopaminérgicos. Sin embargo, con la administración crónica se desarrolla tolerancia a estos efectos neuroendocrinos, y estos no se presentan tan frecuentemente.
- Efectos sobre el comportamiento: Los opioides producen sedación, pero no tan profundamente como los depresores del SNC como los barbitúricos o los anestésicos generales. Una persona a la que se le administra un opioide suele estar letárgica pero excitable.
- Dependencia y Adicción: aparecen cuando se administran de forma repetida, y se cree que es resultado de la desensibilización de los receptores opioides y alteraciones en la interacción entre las proteínas G y el adenilato ciclasa. El síndrome de abstinencia aparece ante una suspensión abrupta de opioides o el uso de antagonistas.
- Dentro de las 8 horas de la suspensión, la persona experimenta lagrimeo, bostezos, sudoración y secreción mucosa.
- A las doce a catorce horas de la suspensión, la persona presenta sacudidas y sueño inquieto.
- El pico ocurre entre las cuarenta y ocho y setenta y dos horas, con dilataciones de las pupilas, incapacidad para comer, piel de gallina, inquietud, taquicardia, temblores motores, calambres musculares, náuseas, diarrea, espasmos intestinales y escalofríos y sofocos alternos. Durante este tiempo, es comprensible que la persona esté irritable, ansiosa y disfórica.
- Dependencia y Adicción: aparecen cuando se administran de forma repetida, y se cree que es resultado de la desensibilización de los receptores opioides y alteraciones en la interacción entre las proteínas G y el adenilato ciclasa. El síndrome de abstinencia aparece ante una suspensión abrupta de opioides o el uso de antagonistas.
Interacciones
Resumir
Contexto
La codeína tiene la capacidad de interactuar con 505 medicamentos, 16 interacciones entre enfermedades y 1 interacción con alimentos.
| Fármacos que interactúan con codeína | |||
|---|---|---|---|
| Fármaco | Interacción | Riesgo | |
| Azelastina (nasal)
Bromperidol Flunarizina Kratom Nabilona Olopatadina (nasal) Orfenadrina Paraldehído Talidomida |
Depresores de SNC | Aumentan los efectos depresores del sistema nervioso central, aumentando el riesgo de sedación excesiva, depresión respiratoria y otros efectos adversos. | X |
| Naltrexona | Agonista opioide | Precipita la abstinencia de opioides y disminuye la respuesta a los agonistas opioides a través de su antagonismo del receptor opioide. | X |
| Samidorfano | Agonista opioide | Disminuye el efecto terapéutico de los agonistas opioides. | X |
| Eluxalodina | Agonista opioide | Efecto de estreñimiento aditivo, tanto la eluxadolina como los opioides aumentan de forma independiente el riesgo de estreñimiento y eventos adversos relacionados. | X |
| Mavorixafor | Sustratos CYP2D6 (Alto riesgo con Inhibidores) | Aumenta la concentración sérica de sustratos de CYP2D6 | X |
| Opioides | Agonistas/Opioides de Opioides (Agonista/Antagonista Mixto) | Los opioides agonistas / antagonistas mixtos parecen reducir los efectos de los agonistas opioides puros a través de la competencia / antagonismo en los sitios del receptor opioide | X |
| Agonistas opioides
Blonanserina Buprenorfina Clormetiazol Daridorexant Droperidol Fenobarbital Flunitrazepam Hidroxizina Lemborexant Loxapina Metotrimeprazina Oxicodona Ropeginterferón Alfa-2b Suvorexant Zolpidem Zuranolona |
Depresores de SNC | Aumentan los efectos depresores del sistema nervioso central de la codeína, aumentando el riesgo de sedación excesiva, depresión respiratoria y otros efectos adversos. | D |
| Alvimopán
Depresores del SNC Nalmefeno |
Agonistas opioides | Generan efectos aditivos o sinérgicos con la codeína, lo que podría aumentar tanto los efectos terapéuticos como los efectos secundarios. | D |
| Sincalida | Medicamentos que afectan la función de la vesícula biliar | Los medicamentos que afectan la función de la vesícula biliar pueden disminuir el efecto terapéutico de Sincalida | D |
| Bebidas alcohólicas
Metoclopramida |
Depresores del SNC | Aumentan los efectos depresores del sistema nervioso central, aumentando el riesgo de sedación excesiva, depresión respiratoria y otros efectos adversos. | C |
La anterior tabla de interacciones es de creación del autor en base al sitio web UpToDate.
Uso clínico
Resumir
Contexto
Dolor leve a moderado
La FDA ha autorizado el uso de codeína para el manejo del dolor leve a moderado, tanto en su forma aguda como crónica, incluyendo su aplicación en pacientes oncológicos y en cuidados paliativos. Sin embargo, su utilización en otras formas de dolor crónico sigue siendo objeto de controversia clínica. La Asociación Internacional para el Estudio del Dolor establece que el dolor crónico es aquel que persiste más allá del período normal de cicatrización tisular, que se estima en tres meses.
Las etiologías más frecuentes del dolor crónico no neoplásico incluyen lumbalgia, síndrome de fibromialgia, osteoartritis y cefaleas. La administración de este opioide en el tratamiento del dolor agudo también genera debate en la comunidad médica, como lo demuestran los hallazgos no concluyentes o equívocos en diversos ensayos clínicos aleatorizados y controlados recientes, en comparación con analgésicos no opioides de venta libre comúnmente utilizados.
Tos crónica
El uso de la codeína para tratar diversas patologías que producen tos crónica no ha sido aprobado por la FDA. La tos crónica puede derivar de varios estados patológicos en los que la codeína de efectividad variable según la etiología subyacente. Aunque se ha demostrado que la codeína reduce la frecuencia y la gravedad de la tos en los pacientes, otros medicamentos como el dextrometorfano han demostrado ser antitusivos superiores y preferidos por los pacientes en algunos estudios.
Síndrome de piernas inquietas
El uso de la codeína para tratar el síndrome de piernas inquietas refractario durante la noche no ha sido aprobado por la FDA. Sin embargo, la dosis prescrita debe ser baja y los pacientes no deben responder a todos los protocolos de tratamiento estándar para el SPI.

Efectos adversos
| Reacciones adversas a Codeína | ||
|---|---|---|
| Sistema implicado | 'Grupo CIOSM' | Tipo de reacción |
| Sistema Nervioso Central (SNC) | Frecuente al inicio del tratamiento, pero con el tiempo desaparece | Somnolencia, mareo, cefalea y confusión mental |
| Sistema Gastrointestinal | Muy frecuentes, por lo que se recomienda ingerir agua para amortiguar los efectos adversos | Estreñimiento, dolor abdominal, náuseas y vómito |
| Sistema Cardiovascular | Poco frecuentes | Hipotensión ortostática, bradicardia |
| Sistema Genitourinario | Poco frecuentes | Retención urinaria |
| Sistema Respiratorio | Raras | Depresión respiratoria severa |
| Sistema inmunológico | Raras | Anafilaxia |
| Otros | Prurito, erupción cutánea, alteraciones de la visión, palpitaciones, raramente sudoración | |
Contraindicaciones
Resumir
Contexto
- Depresión respiratoria grave, ataque agudo de asma, EPOC.
- No se debe utilizar en pacientes menores de doce años.
- Diarrea asociada a colitis pseudomembranosa o causadas por microorganismos invasivos.
- No se recomienda durante el 1 trimestre. No administrar durante el embarazo, a menos que los beneficios superen los riesgos potenciales.
- La codeína está contraindicada en mujeres durante la lactancia. A las dosis terapéuticas habituales la codeína y su metabolito activo pueden estar presentes en la leche materna a dosis muy bajas y es improbable que puedan afectar al bebé lactante. Sin embargo, si el paciente es un metabolizador ultrarápido de CYP2D6, pueden encontrarse en la leche materna a niveles más altos del metabolito activo, morfina, y en muy raras ocasiones esto puede resultar en síntomas de toxicidad opioide en el bebé, que pueden ser mortales.
- Pacientes pediátricos con obesidad o afecciones que puedan afectar la respiración, incluidos aquellos con antecedentes de amigdalectomía o adenoidectomía.
- El uso concomitante de opioides con benzodiazepinas u otros depresores del sistema nervioso central, incluido el alcohol, puede provocar depresión respiratoria, sedación profunda, coma y muerte.
Detección
La codeína y sus principales metabolitos pueden cuantificarse en sangre, plasma u orina para controlar el tratamiento, confirmar un diagnóstico de intoxicación o ayudar en una investigación médico-legal de muerte. Los programas de detección del abuso de drogas generalmente analizan la orina, el cabello, el sudor o la saliva. Muchas pruebas comerciales de detección de opiáceos dirigidas a la morfina presentan reacciones cruzadas apreciables con la codeína y sus metabolitos, pero las técnicas cromatográficas pueden distinguir fácilmente la codeína de otros opiáceos y opioides.
Es importante señalar que el uso de codeína genera cantidades significativas de morfina como producto de excreción. Además, la heroína contiene codeína (o acetil codeína) como impureza y su uso dará como resultado la excreción de pequeñas cantidades de codeína. Los alimentos con semillas de amapola representan otra fuente de niveles bajos de codeína en los biofluidos. Las concentraciones de codeína en sangre o plasma suelen estar en el rango de 50‑300 μg/L en personas que toman el fármaco de forma terapéutica, de 700 a 7000 μg/L en consumidores crónicos y de 1000‑10 000 μg/L en casos de sobredosis aguda fatal.
Sobredosis
Puede producir excitación inicial, ansiedad, insomnio y posteriormente en ciertos casos somnolencia que progresa a estupor o coma, cefalea, miosis, alteraciones de la presión arterial, arritmias, sequedad de boca, reacciones de hipersensibilidad, piel fría y viscosa, taquicardia, convulsiones, trastornos gastrointestinales y depresión respiratoria. En la intoxicación grave puede aparecer apnea, colapso circulatorio, parada cardiaca y muerte. En general, se lleva a cabo un tratamiento sintomático basado en el mantenimiento de la vía aérea, lavado gástrico y administración de carbón activado si se considera necesario, y administración de un antagonista opiáceo específico, la naloxona, por vía intravenosa a las dosis apropiadas.
Presentaciones
Resumir
Contexto
La presentación de la codeína (sola o en combinación con otros medicamentos) es en tableta de liberación inmediata, tableta de liberación prolongada, solución (líquido) y jarabe para tomar por vía oral. Si se usa la codeína para tratar el dolor, suele tomarse cada 4 horas según sea necesario para el dolor. Si se utiliza solución o jarabe de codeína (en combinación con otros medicamentos) para aliviar temporalmente la tos, suele tomarse cada cuatro o seis horas según sea necesario.
Si se usan tabletas de liberación prolongada de codeína para aliviar temporalmente la tos, suele tomarse cada doce horas según sea necesario. Se debe tomar la codeína exactamente como el médico indica, y no se debe suspender repentinamente debido a que la persona puede experimentar síntomas de abstinencia.
Cuando se está tomando codeína en solución oral o jarabe, no se debe utilizar una cuchara doméstica para medir la dosis, más bien se usa un vaso medidor o cuchara que vienen con el medicamento.
Posología de Codeína: [1]
- Oral Comprimidos: adultos y niños > 12 años: 1 comprimido/6 h.
- Como analgésico, si no se obtiene el efecto deseado se puede incrementar a 2 comprimidos/toma, máximo 6 comprimidos/día.
- Máximo 240 mg/día, duración máxima del tratamiento: 3 días.
- Formas líquidas: adultos y niños > 12 años: 10-20 mg, 4 veces/día. [1]
Uso veterinario
Resumir
Contexto
La codeína también se utiliza en medicina veterinaria, aunque su uso es menos común que en medicina humana.
Indicaciones
- Alivio del Dolor: La codeína puede ser utilizada para aliviar el dolor leve a moderado en animales.
- Antitusivo: Al igual que en humanos, la codeína se puede utilizar para suprimir la tos en animales, especialmente en casos de tos crónica que no responde a otros tratamientos.
Administración
- La codeína se administra por vía oral, generalmente en forma de tabletas o jarabe.
- Las dosis deben ser cuidadosamente ajustadas por un veterinario para evitar sobredosis, ya que los animales pueden tener diferentes sensibilidades a los opioides en comparación con los humanos.
Efectos Secundarios
- Los efectos secundarios en animales pueden incluir sedación, estreñimiento, y en algunos casos, depresión respiratoria.
- Los animales pueden mostrar signos de malestar gastrointestinal, como náuseas y vómitos.
Precauciones
- No debe usarse en animales con problemas respiratorios graves, ya que puede deprimir la respiración.
- Se debe tener precaución en animales con enfermedades hepáticas o renales, ya que el metabolismo y la excreción de la codeína pueden verse afectados.
- La codeína puede interactuar con otros medicamentos, por lo que es importante que el veterinario conozca todos los medicamentos que está tomando el animal.
Dependencia y Tolerancia
- Al igual que en humanos, los animales pueden desarrollar dependencia y tolerancia a la codeína, por lo que su uso debe ser monitoreado y, generalmente, es limitado a tratamientos a corto plazo.
Alternativas
- En muchos casos, se pueden considerar alternativas a la codeína, como otros analgésicos no opioides o tratamientos específicos para la causa subyacente del dolor o la tos.
Otros usos
El uso de la codeína como cuidado paliativo para el tratamiento de la diarrea persistente no ha sido aprobado por la FDA, junto con la loperamida son igualmente efectivas para esta indicación. La evaluación por parte del médico y la ponderación del potencial adictivo de la codeína frente al mayor costo de la loperamida, así como las diferencias individuales en la vulnerabilidad del paciente a los efectos adversos, ayudan a determinar si la codeína o la loperamida son una mejor opción.
Controversias
Resumir
Contexto
Adicción a la codeína
Un adicto a la heroína (diamorfina o heroína) u otros opiáceos/opioides puede usar codeína para protegerse de los efectos de la abstinencia durante los períodos en los que su droga preferida no está disponible o es inasequible.
La codeína también está disponible junto con el medicamento contra las náuseas prometazina en forma de jarabe. De marca como Phenergan con Codeína o en forma genérica como Prometazina con codeína, comenzó a mezclarse con refrescos en la década de 1990 como droga recreativa, llamada «jarabe», «lean» o «bebida morada». El rapero Pimp C, del grupo UGK, murió por una sobredosis de esta combinación.
En la actualidad, el fallecido rapero Mac Miller, luchó contra la adicción a la codeína durante gran parte de su vida. Esta tuvo un impacto significativo en su vida personal, sus relaciones y su carrera musical. La adicción de Miller comenzó en su adolescencia, como resultado de la automedicación para la ansiedad y la depresión.
La adicción de Miller afectó negativamente sus relaciones con familiares y amigos. Su comportamiento errático y su falta de fiabilidad causaron tensión y distanciamiento. Además, su adicción lo llevó a tomar decisiones imprudentes que lo pusieron en riesgo. Miller abordó abiertamente su lucha contra la adicción en su música. Este buscó ayuda en varias ocasiones, pues ingresó en centros de rehabilitación y buscó terapia. Trágicamente, la adicción de Miller contribuyó a su muerte prematura el día 7 de septiembre de 2018, a los veintiséis años por una sobredosis accidental de drogas.
Por otro lado, en el 2018, Nigeria, se presentó una epidemia de consumidores adictos a la codeína, donde los escolarizados preferían no ir a clases por tomar Lean. Lo anterior fue debido a que la codeína es importada, pero el jarabe lo fabrican en Nigeria más de veinte compañías farmacéuticas. La agencia antidrogas de Nigeria en una operación, incautaron 24 000 botellas de jarabe de codeína transportadas en un solo camión en Katsina. [2]
La adicción al jarabe es un problema en toda África. Se publicaron informaciones sobre la adicción que provoca en países como Kenia, Ghana, Níger y Chad. En 2016, India prohibió la actividad de numerosas empresas que distribuían codeína después de que se publicaran informes que alertaban de su efecto adictivo.
Anécdotas
Uso en la guerra civil americana
- Durante la guerra civil americana (1861-1865), la codeína y otros derivados del opio fueron ampliamente utilizados para tratar el dolor de los soldados heridos. La facilidad de uso de la codeína en comparación con la morfina hizo que fuera un medicamento popular en los campos de batalla.
Crisis de los Metabolizadores rápidos
- Ha habido casos documentados de individuos con un metabolismo ultra-rápido de la enzima CYP2D6, que convierte la codeína en morfina más rápidamente de lo normal. Esto ha llevado a sobredosis inadvertidas y efectos secundarios graves, especialmente en niños. Uno de los casos más notorios fue el de un niño que murió tras una cirugía menor porque su cuerpo metabolizó la codeína tan rápidamente que alcanzó niveles tóxicos de morfina en su sistema.
Referencias
Bibliografía
Enlaces externos
Wikiwand - on
Seamless Wikipedia browsing. On steroids.