Citocromo c oxidasa
tipo de enzima De Wikipedia, la enciclopedia libre
La enzima citocromo c oxidasa o complejo IV (número EC 1.9.3.1) es una proteína transmembrana que se encuentra incluida en bicapas lipídicas de bacterias y en mitocondrias. Se trata de la última enzima de la cadena de transporte de electrones, recibiendo un electrón de cada uno de las cuatro moléculas de citocromo c; después, los transfiere a una molécula de oxígeno, reduciéndola a dos moléculas de agua. Acoplada a este proceso, se produce una translocación de protones a través de la membrana, lo cual genera un gradiente electroquímico que la enzima ATP sintasa emplea para sintetizar adenosín trifosfato (ATP).[1]
| Citocromo c oxidasa | ||||
|---|---|---|---|---|
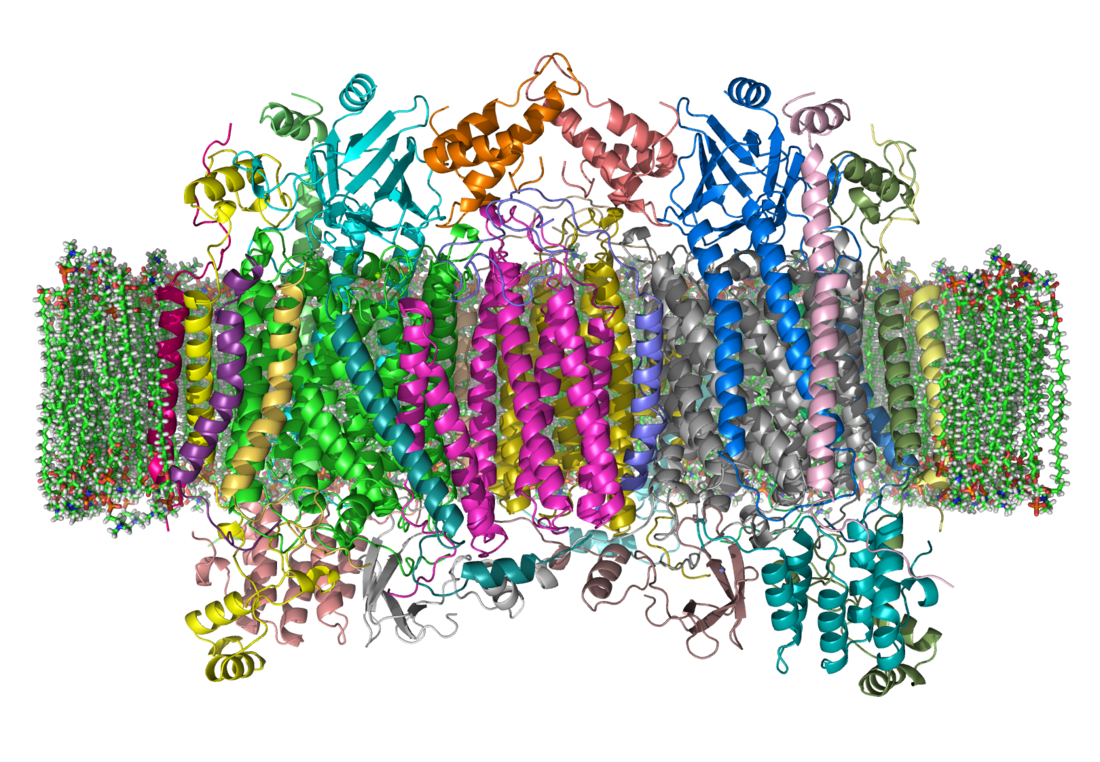
 Estructura cristalina de un homodímero de la citocromo c oxidasa bovina, incluida en la bicapa lipídica. El espacio intermembrana queda en la parte superior del esquema. | ||||
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 1.9.3.1 | |||
| Número CAS | 9001-16-5 | |||
| Ortólogos | ||||
| Especies |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
La reacción catalizada por la enzima puede resumirse como sigue (el término: 4 H+fuera hace referencia a protones expulsados al espacio intermembrana mitoncondrial)
- 4 Fe2+-citocromo c + 8 H+in + O2 → 4 Fe3+-citocromo c + 2 H2O + 4 H+fuera
Estructura
Resumir
Contexto
Estructuralmente, el complejo IV es una proteína integral de membrana que incluye varios grupos prostéticos metálicos así como 13 subunidades, en mamíferos. De estas 13, diez están codificadas por genes situados en el genoma nuclear y tres en el mitocondrial. El complejo posee dos grupos hemo, un citocromo a y otro a3, así como dos centros de cobre (uno denominado CuA y el otro CuB centers.[2] En realidad, el citocromo a3 y el CuB forman un centro binuclear en el cual se produce la reducción del oxígeno molecular a agua.
El citocromo c, elemento anterior en la cadena de transporte de electrones (que está reducido mediante el complejo citocromo bc1, también denominado complejo III), se une a la citocromo c oxidasa en un lugar cercano al centro binuclear. Al acercarse, cede un electrón, se oxida y regresa por tanto a su estado Fe+3. El CuA del complejo IV, que es quien acepta ese electrón, lo cede a su vez al citocromo a, y éste al centro binuclear citocromo a3- CuB. En este último complejo los dos metales, el átomo de hierro y el de cobre, se encuentran a 4.5 Å de distancia entre sí y coordinan un ion hidróxido completamente oxidado.
La cristalografía de rayos X arroja una inusual modificación postraduccional de la citocromo c oxidasa: el C6 de la Tyr 244 y el ε-N de la His 240 (numeración del complejo en bovino). Este enlace es esencial en la acepción de cuatro electrones del complejo binuclear, pues son precisos estos cuatro para reducir el O2 a dos moléculas de agua. El mecanismo de reducción podría estar basado en un estado intermediario peróxido, que daría lugar a la producción de radicales superóxido; la hipótesis más aceptada es la rápida reducción del oxígeno molecular por acepción de los cuatro electrones, lo que redundaría en la ruptura del enlace oxígeno-oxígeno.[3]
Alteraciones genéticas
Los defectos que involucran una mutación que altera la funcionalidad o la estructura de la enzima, dan como resultado un desorden metabólico fetal muy fuerte. Estos problemas se manifiestan en la infancia, y tienen efectos predominantes en tejidos con alta demanda de energía (el cerebro, músculo, hígado, corazón). De entre las enfermedades clasificadas como mitocondriales, las que son de origen en el ensamblado de la citocromo c oxidasa son las más graves.[4]
Intoxicaciones que afectan el complejo IV
Resumir
Contexto
Intoxicación por cianuro
El cianuro (CN-) inhibe de manera competitiva el metabolismo aeróbico al unirse al hemo binuclear de la citocromo oxidasa c (CcO). El nitrito de amilo (C5H11ONO) y el nitrito de sodio (NaNO2) son contrarios a la toxicidad del cianuro en parte por oxidación de la hemoglobina en metahemoglobina, la cual entonces recoge el cianuro. Se piensa que la generación de mHb es el mecanismo principal por el cual NO2- es antagónico al cianuro. Por el otro lado, NO2- puede atravesar una biotransformación para generar óxido nítrico (NO), el cual entonces se vuelve directamente antagónico a la inhibición del citocromo oxidasa por cianuro. En un estudio de antagonismo mediado por nitrito en contra de la inhibición de la fosforilación oxidativa por cianuro fue examinada en células dopaminérgicas N27de ratas. NaNO2 produjo incremento dependiente de tiempo y concentración de los niveles de NO en toda la célula y mitocondria. El recogedor de NO, PTIO (2-fenil-4,4,5,5,-tetrametilimidazol-1-oxil 3-óxido) revirtió este cambio en el incremento mitocondrial y celular de NO. El NO generado de NaNO2 disminuye el consumo de oxígeno de la célula e inhibe la actividad de la CcO. PTIO revirtió la inhibición mediada por NO, y así entregó fuerte evidencia de que NO media la acción de NaNO2. Bajo condiciones similares, KCN inhibe el estado celular del consumo oxígeno en estado 3 y la actividad de la CcO. Pretratamiento con NaNO2 revirtió la inhibición tanto para el consumo de oxígeno como para la actividad de la CcO. El antagonismo del NaNO2 contra el cianuro fue bloqueado por pretratamiento con el recogedor de NO: PTIO. Con lo que concluyeron en que NaNO2 antagoniza el cianuro en su inhibición de la CcO generando NO el cual interactúa directamente con el sitio de acción del KCN a CcO para revertir la toxicidad. In vivo, además de esto también se forma la mHb como se mencionó antes.
Otras anotaciones sobre el mecanismo de inhibición por NO es que es controlada por el flujo de electrones a través de la cadena respiratoria, terminando en un derivado “nitrito” o un compuesto nitroso. De relevancia para la patofisiología celular es que el mecanismo que conlleva al nitrito, también lleva a una degradación oxidativa, protegiendo a las células de la toxicidad del NO. También es posible la intoxicación con CO a la cadena respiratoria mitocondrial en el punto de la CcO, aunque en humanos es algo que aún está bajo estudios el grado que esto alcanza. Otro inhibidor son las azidas (N3-), las cuales hasta ahora se han demostrado, en enzimas bovinas, que potencian la unión de cianuro a la CcO. Otras anotaciones sobre el mecanismo de inhibición por NO es que es controlada por el flujo de electrones a través de la cadena respiratoria, terminando en un derivado “nitrito” o un compuesto nitroso. De relevancia para la patofisiología celular es que el mecanismo que conlleva al nitrito, también lleva a una degradación oxidativa, protegiendo a las células de la toxicidad del NO.[5][6]
Intoxicación por CO, N3-
También es posible la intoxicación con CO a la cadena respiratoria mitocondrial en el punto de la CcO, aunque en humanos es algo que aún está bajo estudios el grado que esto alcanza. Otro inhibidor son las azidas (N3-), las cuales hasta ahora se han demostrado, en enzimas bovinas, que potencian la unión de cianuro a la CcO.[7][8]
Enlaces externos
Referencias
Wikiwand - on
Seamless Wikipedia browsing. On steroids.