Ácido fosforoso
De Wikipedia, la enciclopedia libre
El ácido fosforoso ( a veces llamado ácido ortofosforoso) es un compuesto químico de fórmula H3PO3. Se trata de un ácido es diprótico (realmente solo se ionizan dos protones), no triprótico como pudiera sugerir su fórmula. Es un producto intermedio en la preparación de otros compuestos fosforados. Los derivados orgánicos del ácido fosforoso, compuestos con la fórmula RPO3H2, se denominan ácidos fosfónicos.
| Ácido fosforoso | ||
|---|---|---|
 Modelo 2D del ácido fosforoso | ||
 Modelo tridimensional | ||
| Nombre IUPAC | ||
| Ácido fosfónico | ||
| General | ||
| Otros nombres |
Óxido de Dihidroxifosfina | |
| Fórmula semidesarrollada | H3PO3 | |
| Fórmula estructural |
 | |
| Fórmula molecular |
H 3PO 3 | |
| Identificadores | ||
| Número CAS | 13598-36-2[1] | |
| Número RTECS | SZ6400000 | |
| ChEBI | 44976 | |
| ChEMBL | CHEMBL1235291 | |
| ChemSpider | 10449259 | |
| PubChem | 407 | |
| UNII | C06701 | |
| KEGG | C06701 | |
|
OP(=O)O
| ||
| Propiedades físicas | ||
| Apariencia | Sólido blanco delicuescente | |
| Densidad | 1651 kg/m³; 1,651 g/cm³ | |
| Masa molar | 82 g/mol | |
| Punto de fusión | 73,6 °C (347 K) | |
| Punto de ebullición | Descompone | |
| Propiedades químicas | ||
| Acidez | 1.3, 6.7 pKa | |
| Solubilidad en agua | 310 g/100 mL | |
| Solubilidad | Soluble en alcohol | |
| Peligrosidad | ||
| NFPA 704 |
0
3
1
| |
| Frases R | R22-35 | |
| Frases S | S26-36/37/39-45 | |
| Riesgos | ||
| Piel | Irritante para la piel | |
| Más información | http://www.sigmaaldrich.com/MSDS/[2] | |
| Compuestos relacionados | ||
| Ácido fosfórico | H3PO4 (i.e., PO(OH)3) | |
| Ácido hipofosforoso | H3PO2 (i.e., H2PO(OH)) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Nomenclatura y tautomerismo

El H3PO3 puede describirse de forma más clara mediante su fórmula estructural HPO(OH)2. Esta forma coexiste en equilibrio con un tautómero minoritario, el P(OH)3. La IUPAC recomendó, en 2005, que este último sea llamado ácido fosforoso, y que la forma dihidróxida se denomine ácido fosfónico, ya que solo los compustos fosforados reducidos reciben la terminación "-oso".[3] El tautómero P(OH)3 ha sido observado como un ligando unido al molibdeno.[4][5]
Otros oxiácidos importantes del fósforo son el ácido fosfórico (H3PO4) y el ácido hipofosforoso (H3PO2). Todos los ácidos reducidos fosforosos están sujetos a un tautomerismo similar, en el que hay implicados diversos puentes de H entre O y P.
Estructura y valencias
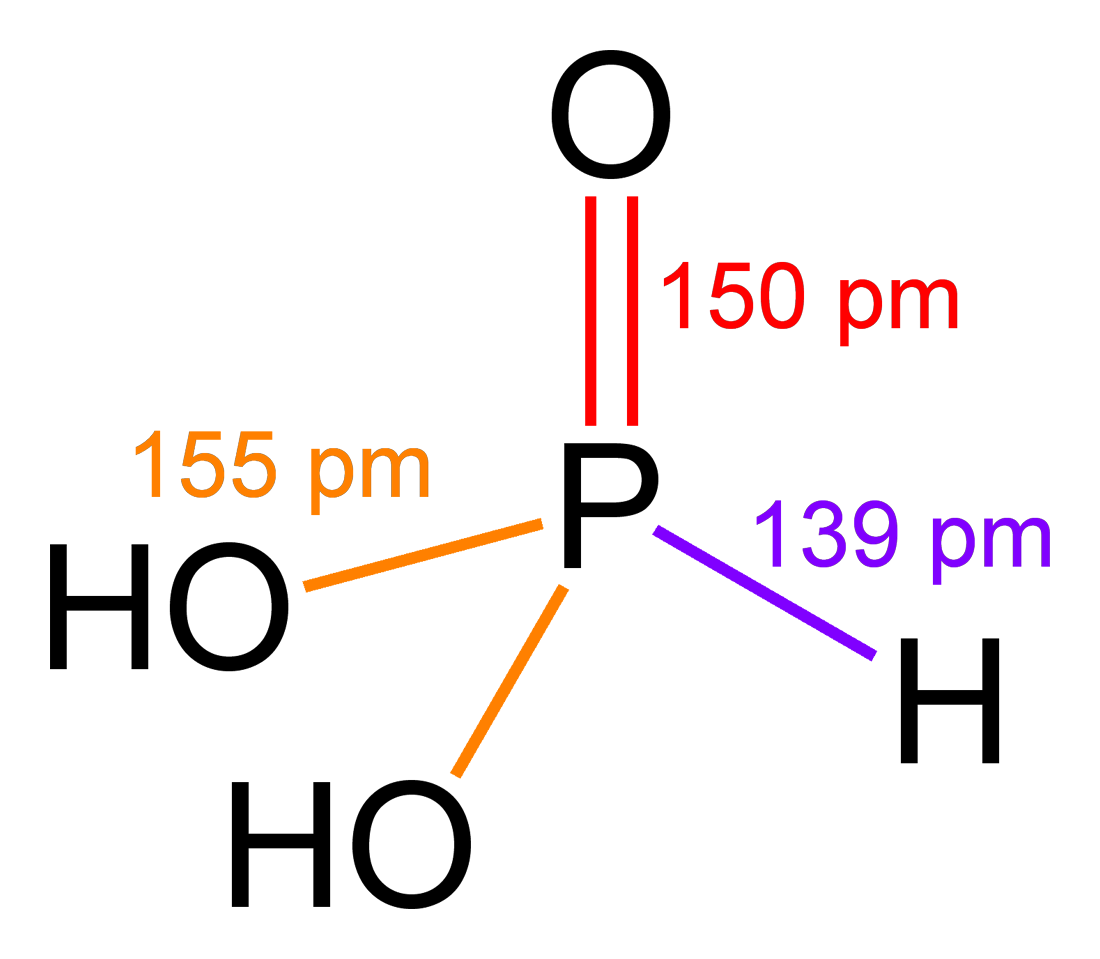
En estado sólido, el HP(O)(OH)2 es tetraédrico con un doble enlace más corto P=O, de 148 pm y dos de mayor longitud, P-O(H), de 154pm. El átomo central de fósforo se encuentra en estado de oxidación (III).
Preparación
Resumir
Contexto
El HPO(OH)2 es el producto de la hidrólisis de su anhídrido, el hexaóxido de tretrafósforo:
A escala industrial, el ácido se prepara mediante la hidrólisis del tricloruro de fósforo en corriente de agua o vapor:
Evaporando suavemente la disolución resultante, se desprende el cloruro de hidrógeno. Tras el desprendimiento y eliminación del agua, queda como residuo el ácido fosforoso, que al enfriar por debajo de 70 °C forma cristales blancos, delicuescentes. [6]
También se puede partir del fosfito de potasio, que también puede servir como precursor:
El proceso consiste en tratar la disolución acuosa de fosfito potásico con un exceso de ácido clorhídrico. Se concentra la solución y se precipita con alcoholes, de modo que el ácido, ya purificado, puede ser separado de las sales.
Propiedades químicas
Resumir
Contexto
Propiedades ácido-base
Por tratarse de un ácido diprótico, presenta dos posibles disociaciones. La primera, con un pKa1 de 1,3 hace que se comporte como un ácido moderadamente fuerte, es decir, bajo determinadas condiciones de concentración o temperatura, puede llegar a disociarse totalmente:
mientras que la segunda disociación corresponde a la de un ácido débil, ya que presenta un pKa2 de 6,7.
por lo que puede formar dos tipos de sales, los fosfitos ácidos o hidrogenofosfitos, a partir del anfolito HPO2(OH)− y los fosfitos neutros, provenientes de la base conjugada, HPO32- .[7]No hay posibilidad de una tercera disociación, ya que, como se ha indicado, el hidrógeno unido directamente al átomo de fósforo no es ionizable, característica esta, que diferencia al ácido fosforoso de la forma más oxidada, el ácido fosfórico, H3PO4.
Propiedades redox
Tanto el ácido fosforoso como sus formas desprotonadas (fosfitos e hidrogenofosfitos) son agentes reductores relativamente fuertes, oxidándose a ácido fosfórico o a fosfatos, respectivamente. Además, el ácido fosforoso, en contacto con el aire se oxida lentamente a ácido fosfórico y a temperaturas próximas a los 200 °C sufre una dismutación, reduciéndose en parte a fosfano (hidruro de fósforo o fosfamina), mientras que otra parte se oxida a ácido fosfórico:[6]
El ácido fosforoso reduce las soluciones de cationes de metales nobles a sus respectivos metales. Cuando el ácido fosforoso se trata con una solución fría de cloruro de mercurio(II), se forma un precipitado blanco de cloruro mercurioso:
En exceso de ácido fosforoso y por calor, la reacción continúa hasta la reducción del cloruro mercurioso a mercurio metálico:
Aplicaciones
La aplicación más importante del ácido fosforoso es la producción de fosfito de plomo dibásico, que es un estabilizador del PVC y polímeros clorados relacionados.[8] También se utiliza en la síntesis de derivados orgánicos (fosfonatos), como el ácido α-aminoetilenfosfónico y en reacciones de aminoalquilación para producir ácidos α-aminofónicos. También se utiliza como un fuerte agente reductor y en la producción de ácido fosforoso, fibras sintéticas, pesticidas organofosforados y del agente para tratamiento de agua altamente eficiente ATMP (ácido amino-tris-metilenfosfonico).
Lecturas recomendadas
- Holleman, A. F.; Wiberg, E. “Inorganic Chemistry.” Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- D. E. C. Corbridge. “Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology.” 5th ed. Elsevier: Ámsterdam. ISBN 0-444-89307-5.
- Concise Inorganic Chemistry J.D.Lee Oxford University Press ISBN 978-81-265-1554-7
Referencias
Wikiwand - on
Seamless Wikipedia browsing. On steroids.