Loading AI tools
De Wikipedia, la enciclopedia libre
La yodación de hidrazona es una reacción orgánica en la que una hidrazona se convierte en yoduro de vinilo por reacción de yodo y una base no nucleófila como DBU.[1][2] La reacción fue reportada por primera vez por Derek Barton en 1962.
La reacción tiene raíces más tempranas con el descubrimiento de 1911 por Wieland y Roseeu a partir de la reacción de las hidrazonas con yodo elemental (sin base), la cual da como resultado el dímero de azina (estructura 2 en el esquema 1).

En la publicación original de Barton,[3] la reacción se optimizó mediante el uso de una base fuerte de guanidina, la adición inversa de la hidrazona a una solución de yodo y la eliminación de agua.
Cuando el yodo como electrófilo se reemplaza por bromuros de selenilo aromáticos, se obtienen los seleniuros de vinilo correspondientes:[4]

El mecanismo de reacción propuesto en la publicación original de Barton se describe a continuación:

La hidrazona es oxidada por yodo en un diazo intermedio. En el siguiente paso, el yodo reacciona como un electrófilo; El desplazamiento de nitrógeno genera un ion yodocarbonio. Cuando el sitio de reacción no está estéricamente impedido, un segundo yoduro puede recombinarse para formar el diyoduro geminal; de lo contrario, una reacción de eliminación conduce al yoduro de vinilo. Cuando hay agua presente, el producto de reacción puede volver a la cetona.
Esta reacción está relacionada con la reacción de Shapiro.
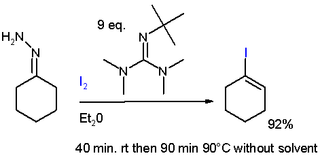
Alcance Un ejemplo de este procedimiento es la reacción de 2,2,6-trimetilciclohexanona a la hidrazona por reacción con hidrazina y trietilamina en etanol a reflujo seguido de la reacción de la hidrazona con yodo en presencia de 2-terc-butil-1,1 , 3,3-tetrametilguanidina (más barata que la DBU) en éter dietílico a temperatura ambiente.[5] Otro ejemplo se puede encontrar en la síntesis total de Danishefsky Taxol.
En un estudio[6] se intenta atrapar cualquier intermedio reactivo de esta reacción con un alqueno interno. Cuando la hidrazona 1 en el esquema 5 se hace reaccionar con yodo y trietilamina en tolueno, el producto de reacción esperado no es el diyoduro 10 a través de la ruta B en un mecanismo de radicales libres. Secuencia de reacción a partir de '1' : reacción de adición de halógeno al intermedio di-yoduro '2' seguido de reacción de eliminación con pérdida de Yoduro de hidrógeno a '3' . En la ruta B, otro equivalente de yodo reacciona al doble enlace azo seguido de la pérdida de HI y la formación de '6' . El enlace de nitrógeno a yodo es débil y homólisis da el nitrógeno radical libre '7' . La pérdida de nitrógeno produce especies radicales '8' . La posición de lectura se transfiere al alqueno en '9' que luego se recombina con yoduro a '10' . Tenga en cuenta que en ausencia del alqueno '8' aceptaría un radical yoduro y el geminal di-yoduro pierde HI para formar el yoduro de vinilo. El proceso real que tiene lugar es la ruta A con eliminación de HI al compuesto diazo 4 seguido de una cicloadición 1,3-dipolar de diazoalcano a la pirazolina 5 con un rendimiento del 85%.

Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.