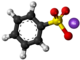
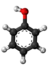
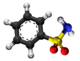
Benzeno sulfonata acido, fenilsulfonata acido aŭ C6H5SO3H estas organika sulfura kombinaĵo, plej simpla aromata sulfonata acido, kiu formas delikvaj kristaloj aŭ blanka solido solvebla en akvo kaj etanolo, iomete solvebla en benzeno kaj nesolvebla en nepolaraj solvantoj tia kial duetila etero. Ĝi estas stokigita sub la formo de alkalo-metalaj saloj. Ĝia akva solvaĵo estas forte acida.
| Fenilsulfonata acido | |||
 | |||
| Kemia strukturo de la Benzeno sulfonata acido | |||
 | |||
| 3D Kemia strukturo de la Benzeno sulfonata acido | |||
| Alternativa(j) nomo(j) | |||
| Hidrogena benzeno-sulfonato | |||
| Kemia formulo | |||
| CAS-numero-kodo | 98-11-3 | ||
| ChemSpider kodo | 7093 | ||
| PubChem-kodo | 7371 | ||
| Fizikaj proprecoj | |||
| Aspekto | Senkolora kristala solido | ||
| Molmaso | 158.17 g mol−1 | ||
| Smiles | c1ccc(cc1)S(=O)(=O)O | ||
| Denseco | 1.32 g/cm3 | ||
| Fandopunkto | |||
| Bolpunkto | 190 °C (374 ℉; 463 K) | ||
| Solvebleco | Akvo:930 g/l | ||
| Nesolvebleco | Nepolaraj solvantoj | ||
| Acideco (pKa) | -2,8 | ||
| Mortiga dozo (LD50) | 1230 mg/kg (muso, buŝa) | ||
| Merck Index |
| ||
| Ekflama temperaturo | 113 °C | ||
| Sekurecaj Indikoj | |||
| Risko | R20 R22 R34 R36 R37 R38 | ||
| Sekureco | S26 S36 S37 S39 S45 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS etikedigo de kemiaĵoj | |||
| GHS Damaĝo-piktogramo |
| ||
| GHS Signalvorto | Damaĝa substanco | ||
| GHS Deklaroj pri damaĝoj | H290, H314, H335 | ||
| GHS Deklaroj pri antaŭgardoj | P280, P301+330+331, P304+340, P305+351+338, P308+310, P310 | ||
(25 °C kaj 100 kPa) | |||
Proprecoj
Benzeno sulfonata acido elmontras reakciojn tipajn de aliaj aromataj sulfonataj acidoj, formante sulfonamidojn, sulfonilajn kloridojn kaj esterojn. Supre ol 220 °C la sulfonigo inversiĝas. Senhidratigo de fosfora kvinoksido donas benzenosulfonatan anhidridon. Konvertado al la koresponda benzenosulfonila klorido efektiviĝas kun fosfora kvinklorido. Ĝi estas forta acido kiam dissociita en akvo. Saloj de benzeno sulfonata acido uzatas en farmaciaĵoj kaj konatas kiel bezilatoj.[1]
Sintezoj
Sintezo 1
- Preparado per traktado de benzeno kaj sulfura trioksido. Ĉi-reakcio ilustras aromatan sulfonigon, kiu konsideratas "unu el la plej gravaj en industria organika kemio".:
Sintezo 2
- Preparado per traktado de benzenosulfonila klorido kaj natria hidroksido:
Sintezo 3
- Preparado per traktado de benzenosulfonila klorido kaj zinka hidroksido:
Sintezo 4
- Preparado per reduktado de benzenosulfonila klorido kun natria sulfito en akva medio:
Sintezo 5
- Preparado per traktado de natria benzenosulfonato kaj klorida acido:
Sintezo 6
- Preparado per interagado de benzeno kun sulfata acido:
Sintezo 7
- Preparado per traktado de benzeno kun sulfurila klorido:
Reakcioj
Reakcio 1
- Sapigo de la benzenosulfonata acido
Reakcio 2
- Esterigo de la benzenosulfonata acido:
Reakcio 3
- Preparado de "benzenosulfonilamido" per amonolizo de la benzenosulfonata acido:
Reakcio 4
- Preparado de klorosulfonata acido (CAS numero: 7790-94-5) per traktado de benzenosulfonata acido kun kloro:
Reakcio 5
- Reakcio kun kloramino:
Reakcio 6
- Reakcio kun sodamido en acida medio:
Reakcio 7
- Reakcio kun nitrozila klorido:
YouTube
Vidu ankaŭ
Literaturo
- Sigma Aldrich
- Chemical Book
- Chemicalland21
- Centroj por Kontrolo kaj Preventado de Malsanoj
- Toxipedia Arkivigite je 2016-03-27 per la retarkivo Wayback Machine
- Purification of Laboratory Chemicals, W.L.F. Armarego, Christina Chai
Referencoj
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.





![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)




![{\displaystyle {\mathsf {{\xrightarrow[{-\;H_{2}O}]{}}\,}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/62924f62b8dd2b05f80404f46e215209bda155c9)

![{\displaystyle {\mathsf {{\xrightarrow[{-\;HCl}]{}}\,}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/b9dba2fec3ed5be5edc819a4d2f1fa984d913593)




![{\displaystyle {\mathsf {{\xrightarrow[{}]{+[H]}}\,}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/88fb0b03b975cfe42ff07b526c4bddf66812655c)

![{\displaystyle {\mathsf {{\xrightarrow[{}]{[OH]^{-}}}\,}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/258ce3c08df9dce17beda55311dbfb79464c8a40)
