Ιστόνη
οικογένεια πρωτεϊνών που συσκευάζουν και διατάσσουν το DNA στα νουκλεοσώματα From Wikipedia, the free encyclopedia
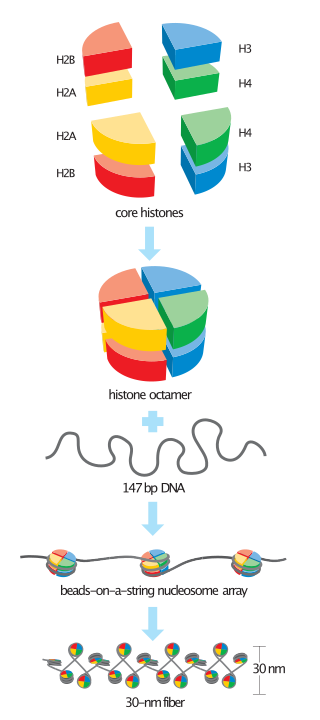
Στη βιολογία, οι ιστόνες είναι πολύ βασικές πρωτεΐνες πλούσιες σε υπολείμματα λυσίνης και αργινίνης που βρίσκονται σε ευκαρυωτικούς κυτταρικούς πυρήνες και στις περισσότερες συνομοταξίες αρχαίων. Λειτουργούν ως καρούλια γύρω από τα οποία τυλίγεται το DNA για να δημιουργήσει δομικές μονάδες που ονομάζονται νουκλεοσώματα.[1][2] Τα νουκλεοσώματα με τη σειρά τους τυλίγονται σε ίνες 30-νανομέτρων που σχηματίζουν σφιχτά στοιβαγμένη χρωματίνη. Οι ιστόνες εμποδίζουν το DNA να μπλέξει και το προστατεύουν από βλάβη. Επιπλέον, οι ιστόνες παίζουν σημαντικό ρόλο στη γονιδιακή ρύθμιση και την αντιγραφή του DNA. Χωρίς ιστόνες, το ξετυλιγμένο DNA στα χρωμοσώματα θα ήταν πολύ μακρύ. Για παράδειγμα, κάθε ανθρώπινο κύτταρο έχει περίπου 1,8 μέτρα DNA εάν τεντωθεί τελείως. Ωστόσο, όταν τυλίγεται γύρω από ιστόνες, αυτό το μήκος μειώνεται σε περίπου 90 μικρόμετρα (0,09 mm) ινών χρωματίνης διαμέτρου 30 nm.[3]
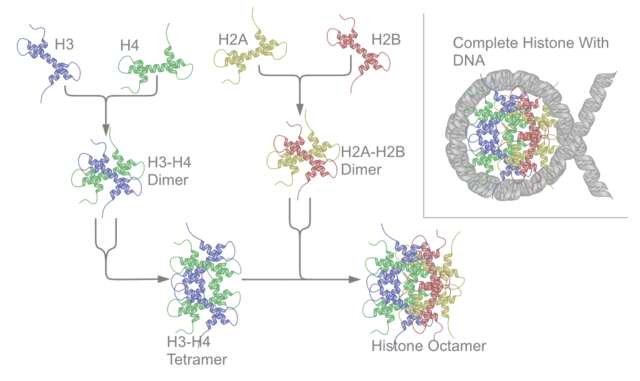
Υπάρχουν πέντε οικογένειες ιστονών που ονομάζονται Η1/Η5 (συνδετικές ιστόνες), Η2, Η3 και Η4 (πυρηνικές ιστόνες). Ο πυρήνας του νουκλεοσώματος σχηματίζεται από δύο Η2Α-Η2Β διμερή και ένα Η3-Η4 τετραμερές. Το σφιχτό τύλιγμα του DNA γύρω από τις ιστόνες είναι σε μεγάλο βαθμό αποτέλεσμα της ηλεκτροστατικής έλξης μεταξύ των θετικά φορτισμένων ιστονών και του αρνητικά φορτισμένου φωσφορικού σκελετού του DNA.
Οι ιστόνες μπορεί να τροποποιηθούν χημικά μέσω της δράσης ενζύμων για τη ρύθμιση της γονιδιακής μεταγραφής. Η πιο κοινή τροποποίηση είναι η μεθυλίωση υπολειμμάτων αργινίνης ή λυσίνης, ή η ακετυλίωση λυσίνης. Η μεθυλίωση μπορεί να επηρεάσει τον τρόπο με τον οποίο άλλες πρωτεΐνες όπως οι παράγοντες μεταγραφής αλληλεπιδρούν με τα νουκλεοσώματα. Η ακετυλίωση της λυσίνης εξαλείφει ένα θετικό φορτίο στη λυσίνη, αποδυναμώνοντας έτσι την ηλεκτροστατική έλξη μεταξύ ιστόνης και DNA με αποτέλεσμα μερικό ξετύλιγμα του DNA καθιστώντας το πιο προσιτό για γονιδιακή έκφραση.
Τάξεις και παραλλαγές

Υπάρχουν πέντε μεγάλες οικογένειες πρωτεϊνών ιστόνης: H1/H5, H2A, H2B, H3, και H4.[2][4][5][6] Οι ιστόνες H2A, H2B, H3 και H4 είναι γνωστές ως ιστόνες πυρήνα ή νουκλεοσωμικές, ενώ οι ιστόνες H1/H5 είναι γνωστές ως ιστόνες σύνδεσης.
Οι ιστόνες του πυρήνα υπάρχουν όλες ως διμερείς, που είναι παρόμοιες στο ότι διαθέτουν όλες τον τομέα πτυχής ιστόνης: τρεις άλφα έλικες που συνδέονται με δύο βρόχους. Είναι αυτή η ελικοειδής δομή που επιτρέπει την αλληλεπίδραση μεταξύ διαφορετικών διμερών, ιδιαίτερα με τον τρόπο της κεφαλής-ουράς (ονομάζεται επίσης μοτίβο χειραψίας).[7] Τα προκύπτοντα τέσσερα διακριτά διμερή ενώνονται στη συνέχεια για να σχηματίσουν έναν οκταμερή πυρήνα νουκλεοσώματος, περίπου 63 Angstroms σε διάμετρο (ένα σωματίδιο που μοιάζει με σωληνοειδές DNA). Περίπου 146 ζεύγη βάσεων (base pairs, bp) DNA τυλίγονται γύρω από αυτό το σωματίδιο του πυρήνα 1,65 φορές σε μια αριστερόστροφη υπερελικοειδή στροφή για να δώσουν ένα σωματίδιο διαμέτρου περίπου 100 Angstroms.[8] Η συνδετική ιστόνη Η1 δεσμεύει το νουκλεόσωμα στις θέσεις εισόδου και εξόδου του DNA, κλειδώνοντας έτσι το DNA στη θέση του [9] και επιτρέποντας το σχηματισμό δομής ανώτερης τάξης. Ο πιο βασικός τέτοιος σχηματισμός είναι η ίνα των 10&nm ή οι χάντρες σε μια διαμόρφωση χορδής. Αυτό περιλαμβάνει το τύλιγμα του DNA γύρω από τα νουκλεοσώματα με περίπου 50 ζεύγη βάσεων DNA που διαχωρίζουν κάθε ζεύγος νουκλεοσωμάτων (αναφέρεται επίσης ως συνδέτης DNA). Οι δομές υψηλότερης τάξης περιλαμβάνουν την ίνα των 30 nm (που σχηματίζει ένα ακανόνιστο ζιγκ-ζαγκ) και την ίνα των 100 nm, αυτές είναι οι δομές που βρίσκονται στα φυσιολογικά κύτταρα. Κατά τη διάρκεια της μίτωσης και της μείωσης, τα συμπυκνωμένα χρωμοσώματα συγκροτούνται μέσω αλληλεπιδράσεων μεταξύ νουκλεοσωμάτων και άλλων ρυθμιστικών πρωτεϊνών.
Οι ιστόνες υποδιαιρούνται σε κανονικές ιστόνες εξαρτώμενες από την αντιγραφή, των οποίων τα γονίδια εκφράζονται κατά τη φάση S του κυτταρικού κύκλου και ανεξάρτητες από την αντιγραφή παραλλαγές ιστονών, που εκφράζονται κατά τη διάρκεια ολόκληρου του κυτταρικού κύκλου. Στα θηλαστικά, τα γονίδια που κωδικοποιούν κανονικές ιστόνες συγκεντρώνονται συνήθως κατά μήκος των χρωμοσωμάτων σε 4 διαφορετικούς τόπους υψηλά διατηρημένους, στερούνται εσωνίων και χρησιμοποιούν μια δομή βρόχου στελέχους στο άκρο 3'. αντί ουράς πολυΑ. Τα γονίδια που κωδικοποιούν παραλλαγές ιστονών δεν είναι συνήθως συγκεντρωμένα, έχουν εσώνια και τα mRNA τους ρυθμίζονται με ουρές πολυΑ.[10] Οι σύνθετοι πολυκύτταροι οργανισμοί έχουν συνήθως μεγαλύτερο αριθμό παραλλαγών ιστονών που παρέχουν μια ποικιλία διαφορετικών λειτουργιών. Πρόσφατα δεδομένα συσσωρεύονται σχετικά με τους ρόλους διαφορετικών παραλλαγών ιστονών που υπογραμμίζουν τους λειτουργικούς δεσμούς μεταξύ των παραλλαγών και τη λεπτή ρύθμιση της ανάπτυξης του οργανισμού.[11] Οι πρωτεΐνες παραλλαγών ιστονών από διαφορετικούς οργανισμούς, η ταξινόμησή τους και τα ειδικά χαρακτηριστικά της παραλλαγής βρίσκονται στη βάση δεδομένων "HistoneDB 2.0 - Variants".[12][13] Αρκετά ψευδογονίδια έχουν επίσης ανακαλυφθεί και ταυτοποιηθεί σε πολύ στενές αλληλουχίες των αντίστοιχων λειτουργικών ορθολογικών γονιδίων τους.[14][15]
The following is a list of human histone proteins, genes and pseudogenes: Ακολουθεί ένας κατάλογος με πρωτεΐνες, γονίδια και ψευδογονίδια ανθρώπινης ιστόνης:[10]
| Υπεροικογένεια | Οικογένεια | Γονίδια που εξαρτώνται από την αντιγραφή | Γονίδια ανεξάρτητα από την αντιγραφή | Ψευδογονίδια |
|---|---|---|---|---|
| Συνδέτης | H1 | H1-1, H1-2, H1-3, H1-4, H1-5, H1-6 | H1-0, H1-7, H1-8, H1-10 | H1-9P, H1-12P |
| Πυρήνας | H2A | H2AC1, H2AC4, H2AC6, H2AC7, H2AC8, H2AC11, H2AC12, H2AC13, H2AC14, H2AC15, H2AC16, H2AC17, H2AC18, H2AC19, H2AC20, H2AC21, H2AC25 | H2AZ1, H2AZ2, MACROH2A1, MACROH2A2, H2AX, H2AJ, H2AB1, H2AB2, H2AB3, H2AP, H2AL1Q, H2AL3 | H2AC2P, H2AC3P, H2AC5P, H2AC9P, H2AC10P, H2AQ1P, H2AL1MP |
| H2B | H2BC1, H2BC3, H2BC4, H2BC5, H2BC6, H2BC7, H2BC8, H2BC9, H2BC10, H2BC11, H2BC12, H2BC13, H2BC14, H2BC15, H2BC17, H2BC18, H2BC21, H2BC26, H2BC12L | H2BK1, H2BW1, H2BW2, H2BW3P, H2BN1 | H2BC2P, H2BC16P, H2BC19P, H2BC20P, H2BC27P, H2BL1P, H2BW3P, H2BW4P | |
| H3 | H3C1, H3C2, H3C3, H3C4, H3C6, H3C7, H3C8, H3C10, H3C11, H3C12, H3C13, H3C14, H3C15, H3-4 | H3-3A, H3-3B, H3-5, H3-7, H3Y1, H3Y2, CENPA | H3C5P, H3C9P, H3P16, H3P44 | |
| H4 | H4C1, H4C2, H4C3, H4C4, H4C5, H4C6, H4C7, H4C8, H4C9, H4C11, H4C12, H4C13, H4C14, H4C15 | H4C16 | H4C10P |
Δομή

Ο πυρήνας νουκλεοσώματος σχηματίζεται από δύο διμερή H2A-H2B και ένα τετραμερές H3-H4, σχηματίζοντας δύο σχεδόν συμμετρικά μισά από τριτογενή δομή συμμετρίας C2. Το ένα μακρομόριο είναι η κατοπτρική εικόνα του άλλου).[8] Τα διμερή Η2Α-Η2Β και το τετραμερές Η3-Η4 παρουσιάζουν επίσης ψευδοδυαδική συμμετρία. Οι 4 ιστόνες 'πυρήνα' (H2A, H2B, H3 και H4) είναι σχετικά παρόμοιες στη δομή και διατηρούνται σε μεγάλο βαθμό μέσω εξέλιξης, ενώ όλες διαθέτουν ένα μοτίβο 'έλικα στροφή έλικα στροφή έλικα (πρωτεϊνικό μοτίβο δέσμευσης DNA που αναγνωρίζει τη συγκεκριμένη αλληλουχία DNA). Μοιράζονται επίσης το χαρακτηριστικό των μακριών 'ουρών' στο ένα άκρο της δομής αμινοξέ4ος - αυτή είναι η θέση της μετα-μεταφραστικής τροποποίησης (βλ. παρακάτω).[16]
Η αρχαϊκή ιστόνη περιέχει μόνο διμερή δομή παρόμοια με H3-H4 που αποτελείται από έναν μόνο τύπο μονάδας. Τέτοιες διμερείς δομές μπορούν να στοιβάζονται σε μια ψηλή υπερέλικα ("υπερνουκλεόσωμα") πάνω στην οποία το DNA περιελίσσεται με τρόπο παρόμοιο με τα καρούλια του νουκλεοσώματος.[17] Μόνο μερικές αρχαϊκές ιστόνες έχουν ουρές.[18]
Η απόσταση μεταξύ των καρουλιών γύρω από τα οποία τα ευκαρυωτικά κύτταρα τυλίγουν το DNA τους έχει προσδιοριστεί ότι κυμαίνεται από 59 έως 70 Å.[19]
Συνολικά, οι ιστόνες κάνουν πέντε τύπους αλληλεπιδράσεων με το DNA:
- Γέφυρες άλατος και δεσμοί υδρογόνου μεταξύ πλευρικών αλυσίδων βασικών αμινοξέων (ιδιαίτερα λυσίνης και αργινίνης) και φωσφορικών οξυγόνων στο DNA
- Τα δίπολα έλικας σχηματίζουν άλφα-έλικες στα Η2Β, Η3 και Η4 που προκαλούν τη συσσώρευση καθαρού θετικού φορτίου στο σημείο αλληλεπίδρασης με αρνητικά φορτισμένες φωσφορικές ομάδες στο DNA
- Δεσμοί υδρογόνου μεταξύ της σκελετού του DNA και της αμιδικής ομάδας στην κύρια αλυσίδα των πρωτεϊνικών ιστονών
- Μη πολικές αλληλεπιδράσεις μεταξύ των σακχάρων ιστονών και δεοξυριβόζης στο DNA
- Μη ειδικές δευτερεύουσες αυλακώσεις των Ν-τερματικών ουρών H3 και H2B σε δύο δευτερεύουσες αυλακώσεις καθεμιάς στο μόριο DNA
Η εξαιρετικά βασική φύση των ιστονών, εκτός από τη διευκόλυνση των αλληλεπιδράσεων DNA-ιστονών, συμβάλλει στη διαλυτότητά τους στο νερό.
Οι ιστόνες υπόκεινται σε μετα-μεταφραστική τροποποίηση από ένζυμα κυρίως στις Ν-τελικές ουρές τους, αλλά και στις σφαιρικές περιοχές τους.[20][21] Τέτοιες τροποποιήσεις περιλαμβάνουν μεθυλίωση, κιτρουλλινοποίηση, ακετυλίωση, φωσφορυλίωση, SUMOποίηση, ουβικιτινοποίηση και ριβοζυλίωση ADP. Αυτό επηρεάζει τη γονιδιακή τους ρύθμιση.
Γενικά, τα γονίδια που είναι ενεργά έχουν λιγότερο δεσμευμένη ιστόνη, ενώ τα ανενεργά γονίδια συνδέονται σε μεγάλο βαθμό με τις ιστόνες κατά τη μεσόφαση.[22] Φαίνεται επίσης ότι η δομή των ιστονών έχει εξελικτικά διατηρηθεί, καθώς οποιεσδήποτε επιβλαβείς μεταλλάξεις θα ήταν σοβαρά δυσπροσαρμοστικές. Όλες οι ιστόνες έχουν ένα πολύ θετικά φορτισμένο Ν-άκρο με πολλά υπολείμματα λυσίνης και αργινίνης.
Εξέλιξη και κατανομή ειδών
Οι ιστόνες του πυρήνα βρίσκονται στον πυρήνα των ευκαρυωτικών κυττάρων και στα περισσότερα αρχαϊκά φύλα, αλλά όχι σε βακτήρια.[18] Τα μονοκύτταρα φύκια που είναι γνωστά ως δινοφύκη θεωρούνταν προηγουμένως ότι είναι οι μόνοι ευκαρυώτες που στερούνται εντελώς ιστόνων,[23] αλλά μεταγενέστερες μελέτες έδειξαν ότι το DNA τους εξακολουθεί να κωδικοποιεί γονίδια ιστόνης.[24] Σε αντίθεση με τις ιστόνες του πυρήνα, ομόλογα των πρωτεϊνών συνδέτη ιστόνης (H1) που είναι πλούσια σε λυσίνη βρίσκονται σε βακτήρια, γνωστά αλλιώς ως νουκλεοπρωτεΐνες HC1/HC2.[25]
Έχει προταθεί ότι οι πρωτεΐνες του πυρήνα των ιστονών σχετίζονται εξελικτικά με το ελικοειδή τμήμα της εκτεταμένης περιοχής ΑΑΑ+ ΑΤΡάσης, την περιοχή C και με την περιοχή αναγνώρισης του Ν-τερματικού υποστρώματος των πρωτεϊνών Clp/Hsp100. Παρά τις διαφορές στην τοπολογία τους, αυτές οι τρεις πτυχές μοιράζονται ένα ομόλογο μοτίβο έλικας-κλώνου-έλικας (helix-strand-helix, HSH).[16] Προτείνεται επίσης ότι μπορεί να έχουν εξελιχθεί από τις ριβοσωματικές πρωτεΐνες (RPS6/RPS15), που και οι δυο είναι βραχείες και βασικές πρωτεΐνες.[26]
Οι αρχαϊκές ιστόνες μπορεί κάλλιστα να μοιάζουν με τους εξελικτικούς πρόδρομους των ευκαρυωτικών ιστόνων.[18] Οι πρωτεΐνες ιστονών είναι από τις πιο συντηρημένες πρωτεΐνες στους ευκαρυώτες, τονίζοντας τον σημαντικό ρόλο τους στη βιολογία του πυρήνα.[2] Αντίθετα, τα ώριμα σπερματοζωάρια χρησιμοποιούν σε μεγάλο βαθμό πρωταμίνες για να συσκευάσουν το γονιδιωματικό τους DNA, πιθανότατα επειδή αυτό τους επιτρέπει να επιτύχουν ακόμη υψηλότερό λόγο συσκευασίας.[27]
Υπάρχουν ορισμένες μορφές παραλλαγής σε ορισμένες από τις κύριες τάξεις. Μοιράζονται την ομολογία της αλληλουχίας αμινοξέων και τη δομική ομοιότητα του πυρήνα με μια συγκεκριμένη τάξη κύριων ιστονών, αλλά έχουν επίσης το δικό τους χαρακτηριστικό που διαφέρει από τις κύριες ιστόνες. Αυτές οι δευτερεύουσες ιστόνες συνήθως εκτελούν συγκεκριμένες λειτουργίες του μεταβολισμού της χρωματίνης. Για παράδειγμα, η ιστόνη τύπου H3 CENPA σχετίζεται μόνο με την κεντρομεριδιακή περιοχή του χρωμοσώματος. Η παραλλαγή της ιστόνης H2A H2A.Z σχετίζεται με τους προαγωγείς ενεργά μεταγραφόμενων γονιδίων και επίσης εμπλέκεται στην πρόληψη της εξάπλωσης της σιωπηλής ετεροχρωματίνης.[28] Επιπλέον, το H2A.Z έχει ρόλους στη χρωματίνη για τη σταθερότητα του γονιδιώματος.[29] Μια άλλη παραλλαγή της H2A η H2A.X φωσφορυλιώνεται στο S139 σε περιοχές γύρω από τα σπασίματα του διπλού κλώνου και επισημαίνει την περιοχή που υφίσταται επιδιόρθωση του DNA.[30] Η ιστόνη H3.3 σχετίζεται με το σώμα των ενεργά μεταγραφόμενων γονιδίων.[31]
Τροποποιήσεις ιστόνης
Συμπίεση κλώνων DNA
Οι ιστόνες λειτουργούν ως καρούλια γύρω από τα οποία τυλίγεται το DNA. Αυτό επιτρέπει τη συμπίεση που είναι απαραίτητη για να χωρέσουν τα μεγάλα γονιδιώματα των ευκαρυωτών μέσα στους κυτταρικούς πυρήνες: το συμπιεσμένο μόριο είναι 40.000 φορές μικρότερο από ένα μη συσκευασμένο μόριο.
Ρύθμιση χρωματίνης

Οι ιστόνες υφίστανται μετα-μεταφραστικές τροποποιήσεις που αλλάζουν την αλληλεπίδρασή τους με το DNA και τις πυρηνικές πρωτεΐνες. Οι ιστόνες Η3 και Η4 έχουν μακριές ουρές που προεξέχουν από το νουκλεόσωμα, οι οποίες μπορούν να τροποποιηθούν ομοιοπολικά σε πολλά σημεία. Οι τροποποιήσεις της ουράς περιλαμβάνουν μεθυλίωση, ακετυλίωση, φωσφορυλίωση, ουβικιτινοποίηση, SUMOποίηση, κιτρουλλινοποίηση και ριβοζυλίωση ADP . Ο πυρήνας των ιστονών H2A και H2B μπορεί επίσης να τροποποιηθεί. Συνδυασμοί τροποποιήσεων, γνωστοί ως σημάδια ιστόνης, θεωρούνται ότι αποτελούν έναν κώδικα, τον λεγόμενο "κώδικα ιστόνης".[32][33] Οι τροποποιήσεις των ιστονών δρουν σε διάφορες βιολογικές διεργασίες όπως γονιδιακή ρύθμιση, επιδιόρθωση του DNA, συμπύκνωση χρωμοσωμάτων (μίτωση) και σπερματογένεση (μείωση).[34]
The common nomenclature of histone modifications is: Η κοινή ονοματολογία των τροποποιήσεων των ιστονών είναι:
- Το όνομα της ιστόνης (π.χ. H3)
- Η συντομογραφία ενός γράμματος αμινοξύ (π.χ. K για λυσίνη) και η θέση του αμινοξέος στην πρωτεΐνη
- Ο τύπος τροποποίησης (Me: μεθυλ, P: φωσφορικό, Ac: ακετύλιο, Ub: ουβικιτίνη)
- Ο αριθμός των τροποποιήσεων (μόνο το Me είναι γνωστό ότι συμβαίνει σε περισσότερα από ένα αντίγραφα ανά υπόλειμμα. 1, 2 ή 3 είναι μονο-, δι- ή τρι-μεθυλίωση)
Άρα το H3K4me1 υποδηλώνει τη μονομεθυλίωση του 4ου υπολείμματος (λυσίνης) από την αρχή (δηλαδή, το Ν-τελικό) της πρωτεΐνης Η3.
| Τύπος της τροποποίησης |
Ιστόνη | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| H3K4 | H3K9 | H3K14 | H3K27 | H3K79 | H3K36 | H4K20 | H2BK5 | H2BK20 | |
| μόνο-μεθυλίωση | H3K4me1-ενεργοποίηση[35] | ενεργοποίηση [36] | ενεργοποίηση [36] | ενεργοποίηση [36][37] | H4K20me- ενεργοποίηση [36] | ενεργοποίηση [36] | |||
| δι-μεθυλίωση | H3K9me2-καταστολή[38] | καταστολή[38] | H3K79me2-καταστολή[37] | ||||||
| τρι-μεθυλίωση | H3K4me3-ενεργοποίηση[39] | H3K9me3-καταστολή[36] | H3K27me3-καταστολή[36] | ενεργοποίηση,[37] repression[36] |
H3K36me3-ενεργοποίηση | καταστολή[38] | |||
| ακετυλίωση | ενεργοποίηση[40] | H3K9ac ενεργοποίηση [39] | ενεργοποίηση [39] | H3K27ac- ενεργοποίηση [41] | ενεργοποίηση | ||||
Τροποποίηση

Έχει περιγραφεί ένας τεράστιος κατάλογος τροποποιήσεων ιστόνης, αλλά εξακολουθεί να λείπει η λειτουργική κατανόηση των περισσότερων. Συλλογικά, πιστεύεται ότι οι τροποποιήσεις ιστονών μπορεί να αποτελούν τη βάση ενός κώδικα ιστόνης, όπου οι συνδυασμοί τροποποιήσεων ιστονών έχουν συγκεκριμένες σημασίες. Ωστόσο, τα περισσότερα λειτουργικά δεδομένα αφορούν μεμονωμένες σημαντικές τροποποιήσεις ιστόνης που είναι βιοχημικά επιδεκτικές λεπτομερούς μελέτης.
Χημεία
Μεθυλίωση λυσίνης

Η προσθήκη μιας, δύο ή πολλών μεθυλοομάδων στη λυσίνη έχει μικρή επίδραση στη χημεία των ιστονών. Η μεθυλίωση αφήνει ανέπαφο το φορτίο της λυσίνης και προσθέτει έναν ελάχιστο αριθμό ατόμων, έτσι οι στερεοχημικές αλληλεπιδράσεις είναι ως επί το πλείστον ανεπηρέαστες. Ωστόσο, πρωτεΐνες που περιέχουν περιοχές Tudor, χρωμο ή PHD, μεταξύ άλλων, μπορούν να αναγνωρίσουν τη μεθυλίωση της λυσίνης με εξαιρετική ευαισθησία και να διαφοροποιήσουν τη μονο, δι και τριμεθυλ λυσίνη, στο βαθμό που, για ορισμένες λυσίνες (π.χ.: H4K20) μονο, δι και τρι - μεθυλίωση φαίνεται να έχει διαφορετικές σημασίες. Εξαιτίας αυτού, η μεθυλίωση της λυσίνης τείνει να είναι ένα πολύ κατατοπιστικό σημάδι και κυριαρχεί στις γνωστές λειτουργίες τροποποίησης ιστονών.
Σεροτονυλίωση (serotonylation) γλουταμίνης
Πρόσφατα αποδείχθηκε ότι η προσθήκη μιας ομάδας σεροτονίνης στη θέση 5 γλουταμίνης του Η3, συμβαίνει σε σεροτονινεργικά κύτταρα όπως οι νευρώνες. Αυτό είναι μέρος της διαφοροποίησης των σεροτονινεργικών κυττάρων. Αυτή η μετα-μεταφραστική τροποποίηση συμβαίνει σε συνδυασμό με την τροποποίηση της H3K4me3. Η σεροτονυλίωση ενισχύει τη δέσμευση του γενικού παράγοντα μεταγραφής TFIID στο πλαίσιο TATA.[42]
Μεθυλίωση αργινίνης

Αυτό που ειπώθηκε παραπάνω για τη χημεία της μεθυλίωσης της λυσίνης ισχύει επίσης για τη μεθυλίωση της αργινίνης και για ορισμένες πρωτεϊνικές περιοχές - π.χ. οι περιοχές Tudor – που μπορεί να είναι ειδικές για τη μεθυλαργινίνη αντί για τη μεθυλλυσίνη. Η αργινίνη είναι γνωστό ότι είναι μονο- ή δι-μεθυλιωμένη και η μεθυλίωση μπορεί να είναι συμμετρική ή ασύμμετρη, δυνητικά με διαφορετικές σημασίες.
Κιτρουλλινοποίηση της αργινίνης
Τα ένζυμα που ονομάζονται απιμινάσες πεπτιδυλαργινίνης (peptidylarginine deiminases, PADs) υδρολύουν την ομάδα ιμίνης των αργινινών και προσαρτούν μια κετοομάδα, έτσι ώστε να υπάρχει ένα λιγότερο θετικό φορτίο στο υπόλειμμα του αμινοξέος. Αυτή η διαδικασία έχει εμπλακεί στην ενεργοποίηση της γονιδιακής έκφρασης καθιστώντας τις τροποποιημένες ιστόνες λιγότερο στενά συνδεδεμένες με το DNA και καθιστώντας έτσι τη χρωματίνη πιο προσιτή.[43] Τα PAD μπορούν επίσης να παράγουν το αντίθετο αποτέλεσμα αφαιρώντας ή αναστέλλοντας τη μονομεθυλίωση των υπολειμμάτων αργινίνης στις ιστόνες και έτσι ανταγωνίζονται τη θετική επίδραση που έχει η μεθυλίωση της αργινίνης στη μεταγραφική δραστηριότητα.[44]
Ακετυλίωση λυσίνης

Η προσθήκη μιας ακετυλομάδας έχει σημαντική χημική επίδραση στη λυσίνη καθώς εξουδετερώνει το θετικό φορτίο. Αυτό μειώνει την ηλεκτροστατική έλξη μεταξύ της ιστόνης και της αρνητικά φορτισμένης ραχοκοκαλιάς του DNA, χαλαρώνοντας τη δομή της χρωματίνης. Οι πολύ ακετυλιωμένες ιστόνες σχηματίζουν μια πιο προσιτή χρωματίνη και τείνουν να συνδέονται με ενεργή μεταγραφή. Η ακετυλίωση της λυσίνης φαίνεται να είναι λιγότερο ακριβής ως προς τη σημασία από τη μεθυλίωση, καθώς οι ακετυλομεταφοράσες των ιστονών τείνουν να δρουν σε περισσότερες από μία λυσίνες. Προφανώς αυτό αντανακλά την ανάγκη αλλαγής πολλών λυσινών για να έχουν σημαντική επίδραση στη δομή της χρωματίνης. Η τροποποίηση περιλαμβάνει το την H3K27ac.
Φωσφορυλίωση σερίνης/θρεονίνης/τυροσίνης

Η προσθήκη μιας αρνητικά φορτισμένης ομάδας φωσφορικών μπορεί να οδηγήσει σε σημαντικές αλλαγές στη δομή της πρωτεΐνης, οδηγώντας στον καλά χαρακτηρισμένο ρόλο της φωσφορυλίωσης στον έλεγχο της πρωτεϊνικής λειτουργίας. Δεν είναι σαφές ποιες δομικές επιπτώσεις έχει η φωσφορυλίωση των ιστονών, αλλά η φωσφορυλίωση τους έχει σαφείς λειτουργίες ως μετα-μεταφραστική τροποποίηση, και έχουν απεικονιστεί τομείς σύνδεσης όπως το BRCT.
Επιδράσεις στη μεταγραφή
Οι περισσότερες καλά μελετημένες τροποποιήσεις ιστονών εμπλέκονται στον έλεγχο της μεταγραφής.
Ενεργά μεταγραμμένα γονίδια
Δύο τροποποιήσεις ιστόνης συνδέονται ιδιαίτερα με την ενεργή μεταγραφή:
- Τριμεθυλίωση H3 λυσίνης 4 (H3K4me3)
- Αυτή η τριμεθυλίωση συμβαίνει στον υποκινητή των ενεργών γονιδίων [45][46][47] και εκτελείται από το σύμπλοκο COMPASS.[48][49][50]. Παρά τη διατήρηση αυτού του συμπλέγματος και της τροποποίησης της ιστόνης από ζυμομύκητες μέχρι τα θηλαστικά, δεν είναι απολύτως σαφές τι ρόλο παίζει αυτή η τροποποίηση. Ωστόσο, είναι ένας εξαιρετικός δείκτης ενεργών προαγωγών και το επίπεδο αυτής της τροποποίησης ιστόνης στον προαγωγέα ενός γονιδίου συσχετίζεται ευρέως με τη μεταγραφική δραστηριότητα του γονιδίου. Ο σχηματισμός αυτού του δείκτη συνδέεται με τη μεταγραφή με έναν μάλλον περίπλοκο τρόπο: νωρίς στην μεταγραφή ενός γονιδίου, η RNA πολυμεράση II υφίσταται αλλαγή από 'έναρξη' σε 'επιμήκυνση', που χαρακτηρίζεται από μια αλλαγή στις καταστάσεις φωσφορυλίωσης της RNA πολυμεράσης II στον τερματικό τομέα C (C terminal domain, CTD ). Το ίδιο ένζυμο που φωσφορυλιώνει το CTD φωσφορυλιώνει επίσης το σύμπλεγμα Rad6,[51][52] το οποίο με τη σειρά του προσθέτει έναν δείκτη ουβικιτίνης στο H2B K123 (K120 στα θηλαστικά).[53] Το H2BK123Ub εμφανίζεται σε όλες τις μεταγραφόμενες περιοχές, αλλά αυτό το σημάδι απαιτείται στην COMPASS για την τριμεθυλίωση του H3K4 στους προαγωγείς.[54][55]
- Τριμεθυλίωση H3 λυσίνης 36 (H3K36me3)
- Αυτή η τριμεθυλίωση συμβαίνει στο σώμα των ενεργών γονιδίων και εναποτίθεται από την μεθυλτρανσφεράσης Set 2.[56] Αυτή η πρωτεΐνη συνδέεται με την επιμήκυνση RNA πολυμεράσης II και η H3K36Me3 είναι ενδεικτική ενεργά μεταγραφόμενων γονιδίων.[57] Η H3K36Me3 αναγνωρίζεται από το σύμπλεγμα αποακετυλάσης ιστόνης Rpd3, το οποίο αφαιρεί τις τροποποιήσεις ακετυλίου από τις περιβάλλουσες ιστόνες, αυξάνοντας τη συμπίεση της χρωματίνης και καταστέλλοντας την ψευδή μεταγραφή.[58][59][60] Η αυξημένη συμπίεση της χρωματίνης αποτρέπει τους μεταγραφικούς παράγοντες από την πρόσβαση στο DNA και μειώνει την πιθανότητα έναρξης νέων μεταγραφικών συμβάντων εντός του σώματος του γονιδίου. Αυτή η διαδικασία επομένως βοηθά να διασφαλιστεί ότι η μεταγραφή δεν διακόπτεται.
Κατεσταλμένα γονίδια
Τρεις τροποποιήσεις ιστόνης συνδέονται ιδιαίτερα με τα κατεσταλμένα γονίδια:
- Τριμεθυλίωση H3 λυσίνης 27 (H3K27me3)
- Αυτή η τροποποίηση ιστόνης εναποτίθεται από το πολυκομβικό σύμπλοκο PRC2.[61] Είναι ένας σαφής δείκτης γονιδιακής καταστολής,[62] και πιθανότατα δεσμεύεται από άλλες πρωτεΐνες για να ασκήσει κατασταλτική λειτουργία. Ένα άλλο πολυκομβικό σύμπλοκο, το PRC1, μπορεί να δεσμεύσει την H3K27me3[62] και προσθέτει την τροποποίηση ιστόνης H2AK119Ub που βοηθά στη συμπύκνωση της χρωματίνης.[63][64] Με βάση αυτά τα δεδομένα φαίνεται ότι η PRC1 στρατολογείται μέσω της δράσης της PRC2, ωστόσο, πρόσφατες μελέτες δείχνουν ότι η PRC1 στρατολογείται στις ίδιες τοποθεσίες απουσία PRC2.[65][66]
- Δι και τρι-μεθυλίωση της H3 λυσίνης 9 (H3K9me2/3)
- Η H3K9me2/3 είναι ένας καλά χαρακτηρισμένος δείκτης για την ετεροχρωματίνη και, ως εκ τούτου, συνδέεται ισχυρά με την γονιδιακή καταστολή. Ο σχηματισμός της ετεροχρωματίνης έχει μελετηθεί καλύτερα στη ζύμη Schizosaccharomyces pombe, όπου ξεκινά με τη στρατολόγηση του συμπλόκου μεταγραφικής αποσιώπισης που επάγεται από RNA (RNA-induced transcriptional silencing, RITS) σε δίκλωνα RNA που παράγονται από κεντρομεριδιακές επαναλήψεις.[67] Το RITS στρατολογεί την Clr4 μεθυλομεταφοράση ιστόνης που εναποθέτει την H3K9me2/3.[68] Αυτή η διαδικασία ονομάζεται μεθυλίωση ιστόνης. Η H3K9Me2/3 χρησιμεύει ως θέση δέσμευσης για τη στρατολόγηση του Swi6 (πρωτεΐνη ετεροχρωματίνης 1 ή (heterochromatin protein 1, HP1), ένας άλλος κλασικός δείκτης ετεροχρωματίνης), [69][70] που με τη σειρά του επιστρατεύει περαιτέρω κατασταλτικές δραστηριότητες συμπεριλαμβανομένων τροποποιητών ιστόνης όπως αποακετυλάσες ιστόνης και μεθυλομεταφοράσες ιστόνης.[71]
- Τριμεθυλίωση της H4 λυσίνης 20 (H4K20me3)
- Αυτή η τροποποίηση συνδέεται στενά με την ετεροχρωματίνη,[72][73] αν και η λειτουργική της σημασία παραμένει ασαφής. Αυτό το σημάδι τοποθετείται από τη μεθυλομεταφοράση Suv4-20h, η οποία τουλάχιστον εν μέρει στρατολογείται από την πρωτεΐνη ετεροχρωματίνης 1.[72]
Δισθενείς προαγωγείς
Η ανάλυση των τροποποιήσεων ιστονών σε εμβρυϊκά βλαστοκύτταρα (και άλλα βλαστοκύτταρα) αποκάλυψε πολλούς προαγωγείς γονιδίων που φέρουν και τα δύο H3K4Me3 όσο και H3K27Me3, με άλλα λόγια αυτοί οι προαγωγείς εμφανίζουν ενεργοποίηση και καταστολή σημαδιών ταυτόχρονα. Αυτός ο περίεργος συνδυασμός τροποποιήσεων σηματοδοτεί γονίδια που είναι έτοιμα για μεταγραφή. Δεν απαιτούνται στα βλαστοκύτταρα, αλλά απαιτούνται γρήγορα μετά τη διαφοροποίηση σε ορισμένες γενεαλογίες. Μόλις το κύτταρο αρχίσει να διαφοροποιείται, αυτοί οι δισθενείς προαγωγείς αναλύονται είτε σε ενεργές, είτε σε κατασταλτικές καταστάσεις ανάλογα με την επιλεγμένη γενεαλογία.[74]
Άλλες λειτουργίες
Επιδιόρθωση βλάβης στο DNA
Η επισήμανση σημείων βλάβης του DNA είναι μια σημαντική λειτουργία για τις τροποποιήσεις ιστονών. Χωρίς δείκτη επιδιόρθωσης, το DNA θα καταστρεφόταν από ζημιές που συσσωρεύονταν από πηγές όπως η υπεριώδης ακτινοβολία του ήλιου.
- Φωσφορυλίωση του H2AX στη σερίνη 139 (γH2AX)
- Η φωσφορυλιωμένη H2AX (επίσης γνωστή ως γάμμα H2AX) είναι δείκτης για διασπάσεις διπλού κλώνου DNA,[75] και αποτελεί μέρος της απόκρισης σε βλάβη του DNA.[30][76] Η H2AX φωσφορυλιώνεται νωρίς μετά την ανίχνευση θραύσης διπλού κλώνου DNA και σχηματίζει μια περιοχή που εκτείνεται σε πολλές κιλοβάσεις εκατέρωθεν της βλάβης.[75][77][78] Η γάμμα H2AX δρα ως δεσμευτική θέση για την πρωτεΐνη MDC1, η οποία με τη σειρά της στρατολογεί βασικές πρωτεΐνες επιδιόρθωσης του DNA [79] (Αυτό το περίπλοκο θέμα εξετάζεται καλά στο [80]) και ως εκ τούτου, η γάμμα H2AX αποτελεί ένα ζωτικό μέρος του μηχανισμού που διασφαλίζει τη σταθερότητα του γονιδιώματος.
- Ακετυλίωση H3 λυσίνης 56 (H3K56Ac)
- Η H3K56Acx απαιτείται για τη σταθερότητα του γονιδιώματος.[81][82], η H3K56 ακετυλιώνεται από το σύμπλοκο p300/Rtt109,[83][84][85] αλλά αποακετυλιώνεται ταχέως γύρω από θέσεις βλάβης του DNA. Απαιτείται επίσης ακετυλίωση της H3K56 για τη σταθεροποίηση στις διχάλες αντιγραφής που έχουν σταματήσει, αποτρέποντας την επικίνδυνη κατάρρευση στις διχάλες αναπαραγωγής.[86][87] Αν και γενικά τα θηλαστικά κάνουν πολύ μεγαλύτερη χρήση τροποποιήσεων ιστονών από τους μικροοργανισμούς, ένας σημαντικός ρόλος της H3K56Ac στην αντιγραφή του DNA υπάρχει μόνο στους μύκητες και αυτό έχει γίνει στόχος για την ανάπτυξη αντιβιοτικών.[88]
- Τριμεθυλίωση της H3 λυσίνης 36 (H3K36me3)
- Η H3K36me3 έχει την ικανότητα να στρατολογεί το σύμπλεγμα MSH2-MSH6 (hMutSα) της οδού επιδιόρθωσης ασυμφωνίας DNA.[89] Με συνέπεια, περιοχές του ανθρώπινου γονιδιώματος με υψηλά επίπεδα της H3K36me3 συσσωρεύουν λιγότερες σωματικές μεταλλάξεις λόγω της δραστηριότητας επιδιόρθωσης ασυμφωνίας.[90]
Συμπύκνωση χρωμοσωμάτων
- Φωσφορυλίωση της Η3 στη σερίνη 10 (φωσφο-H3S10)
- Η μιτωτική κινάση aurora B φωσφορυλιώνει την ιστόνη Η3 στη σερίνη 10, προκαλώντας έναν καταρράκτη αλλαγών που μεσολαβούν στη συμπύκνωση των μιτωτικών χρωμοσωμάτων.[91][92] Επομένως, τα συμπυκνωμένα χρωμοσώματα χρωματίζονται πολύ έντονα για αυτό το σημάδι, αλλά η φωσφορυλίωση της H3S10 είναι επίσης παρούσα σε ορισμένες θέσεις χρωμοσωμάτων εκτός της μίτωσης, για παράδειγμα στην περικεντρική ετεροχρωματίνη των κυττάρων κατά τη διάρκεια του G2. Η φωσφορυλίωση της H3S10 έχει επίσης συνδεθεί με βλάβη του DNA που προκαλείται από το σχηματισμό βρόχου R-loop σε θέσεις υψηλής μεταγραφής. [93]
- Φωσφορυλίωση της H2B στη σερίνη 10/14 (φωσφο-H2BS10/14)
- Η φωσφορυλίωση του H2B στη σερίνη 10 (ζύμη) ή τη σερίνη 14 (θηλαστικά) συνδέεται επίσης με τη συμπύκνωση της χρωματίνης, αλλά για τον πολύ διαφορετικό σκοπό της μεσολάβησης της συμπύκνωσης χρωμοσωμάτων κατά την απόπτωση.[94][95] Αυτό το σημάδι δεν είναι απλώς ένας όψιμος παρατηρητής στην απόπτωση, καθώς οι μεταλλάξεις αυτού του υπολείμματος που φέρουν οι ζυμομύκητες είναι ανθεκτικές στον αποπτωτικό κυτταρικό θάνατο που προκαλείται από το υπεροξείδιο του υδρογόνου.
Εθισμός
Οι επιγενετικές τροποποιήσεις των ουρών ιστονών σε συγκεκριμένες περιοχές του εγκεφάλου είναι κεντρικής σημασίας στους εθισμούς.[96][97][98] Μόλις εμφανιστούν συγκεκριμένες επιγενετικές αλλοιώσεις, φαίνεται να είναι μακροχρόνιες "μοριακές ουλές" που μπορεί να ευθύνονται για την εμμονή των εθισμών.[96]
Οι καπνιστές τσιγάρου (περίπου το 15% του πληθυσμού των ΗΠΑ) είναι συνήθως εθισμένοι στη νικοτίνη.[99] Μετά από 7 ημέρες θεραπείας με νικοτίνη ποντικών, η ακετυλίωση τόσο της ιστόνης Η3 όσο και της ιστόνης Η4 αυξήθηκε στον υποκινητή FosB στον επικλινή πυρήνα του εγκεφάλου, προκαλώντας αύξηση 61% στην έκφραση FosB.[100]. Αυτό θα αυξήσει επίσης την έκφραση της παραλλαγής ματίσματος δέλτα FosB. Στον επικλινή πυρήνα του εγκεφάλου, το δέλτα FosB λειτουργεί ως "παρατεταμένος μοριακός διακόπτης" και "κύρια πρωτεΐνη ελέγχου" στην ανάπτυξη ενός εθισμού.[101][102]
Περίπου το 7% του πληθυσμού των ΗΠΑ είναι εθισμένος στο αλκοόλ. Σε αρουραίους που εκτέθηκαν σε αλκοόλ για έως και 5 ημέρες, παρατηρήθηκε αύξηση της ακετυλίωσης της ιστόνης 3 λυσίνης 9 στον υποκινητή της προνοσισεπτίνης στο σύμπλεγμα αμυγδαλή του εγκεφάλου. Αυτή η ακετυλίωση είναι ένα σημάδι ενεργοποίησης για την προνοσισεπτίνη. Το σύστημα υποδοχέα οπιοειδών νοσισεπτίνης/νοσισεπτίνης εμπλέκεται στις ενισχυτικές ή ρυθμιστικές επιδράσεις του αλκοόλ.[103]
Ο εθισμός στη μεθαμφεταμίνη εμφανίζεται σε περίπου 0,2% του πληθυσμού των ΗΠΑ.[104] Η χρόνια χρήση μεθαμφεταμίνης προκαλεί μεθυλίωση της λυσίνης στη θέση 4 της ιστόνης 3 που βρίσκεται στους προαγωγείς του c-fos και στα γονίδια C-C υποδοχέας 2 χημειοκίνης (ccr2), ενεργοποιώντας αυτά τα γονίδια στον επικλινή πυρήνα (nucleus accumbens, NAc).[105] Το c-fos είναι γνωστό ότι είναι σημαντικό στον εθισμό.[106] Το γονίδιο ccr2 είναι επίσης σημαντικό στον εθισμό, καθώς η μεταλλακτική αδρανοποίηση αυτού του γονιδίου βλάπτει τον εθισμό.[105]
Σύνθεση
Το πρώτο βήμα του διπλασιασμού της δομής της χρωματίνης είναι η σύνθεση πρωτεϊνών ιστόνης: H1, H2A, H2B, H3, H4. Αυτές οι πρωτεΐνες συντίθενται κατά τη φάση S του κυτταρικού κύκλου. Υπάρχουν διάφοροι μηχανισμοί που συμβάλλουν στην αύξηση της σύνθεσης ιστόνης.
Ζυμομύκητες
Οι ζυμομύκητες φέρουν ένα ή δύο αντίγραφα κάθε γονιδίου ιστόνης, τα οποία δεν είναι ομαδοποιημένα αλλά μάλλον διάσπαρτα στα χρωμοσώματα. Η μεταγραφή του γονιδίου ιστόνης ελέγχεται από πολλές γονιδιακές ρυθμιστικές πρωτεΐνες όπως παράγοντες μεταγραφής που συνδέονται με περιοχές προαγωγέων ιστόνης. Σε εκκολαπτόμενους ζυμομύκητες, το υποψήφιο γονίδιο για την ενεργοποίηση της έκφρασης του γονιδίου ιστόνης είναι το SBF. Ο SBF είναι ένας μεταγραφικός παράγοντας που ενεργοποιείται στην όψιμη φάση G1, όταν διαχωρίζεται από τον καταστολέα του Whi5. Αυτό συμβαίνει όταν το Whi5 φωσφορυλιώνεται από το Cdc8 που είναι ένα G1/S Cdk.[107] Η καταστολή της έκφρασης του γονιδίου ιστόνης εκτός των φάσεων S εξαρτάται από τις πρωτεΐνες Hir που σχηματίζουν ανενεργή δομή χρωματίνης στον τόπο των γονιδίων ιστόνης, προκαλώντας τον αποκλεισμό των μεταγραφικών ενεργοποιητών.[108][109]
Μετάζωα
Στα μετάζωα η αύξηση του ρυθμού σύνθεσης ιστόνης οφείλεται στην αύξηση της επεξεργασίας του προ-mRNA στην ώριμη μορφή του καθώς και στη μείωση της αποικοδόμησης του mRNA. Αυτό οδηγεί σε αύξηση του ενεργού mRNA για μετάφραση πρωτεϊνών ιστόνης. Ο μηχανισμός για την ενεργοποίηση του mRNA έχει βρεθεί ότι είναι η αφαίρεση ενός τμήματος του 3' άκρου του κλώνου του mRNA και εξαρτάται από τη συσχέτιση με την πρωτεΐνη δέσμευσης στελέχους-βρόχου (stem-loop binding protein ,SLBP).[110] Το SLBP σταθεροποιεί επίσης τα mRNA ιστόνης κατά τη φάση S αναστέλλοντας την αποικοδόμηση από τη νουκλεάση 3'hExo .[111] Τα επίπεδα SLBP ελέγχονται από πρωτεΐνες του κυτταρικού κύκλου, με αποτέλεσμα η SLBP να συσσωρεύεται καθώς τα κύτταρα εισέρχονται στη φάση S και αποικοδομούνται καθώς τα κύτταρα φεύγουν από τη φάση S. Τα SLBP επισημαίνονται για αποικοδόμηση με φωσφορυλίωση σε δύο υπολείμματα θρεονίνης από κινάσες εξαρτώμενες από κυκλίνη, πιθανώς την κυκλίνη A/cdk2, στο τέλος της φάσης S.[112] Τα μετάζωα έχουν επίσης πολλά αντίγραφα γονιδίων ιστονών συγκεντρωμένα σε χρωμοσώματα που εντοπίζονται σε δομές που ονομάζονται σώματα Cajal όπως προσδιορίζονται από ανάλυση σύλληψης χρωμοσωμικής διαμόρφωσης σε όλο το γονιδίωμα (4C-Seq).[113]
Σχέση μεταξύ ελέγχου κυτταρικού κύκλου και σύνθεσης
Η πυρηνική πρωτεΐνη Αταξία-Τηλαγγειεκτασία (Nuclear protein Ataxia-Telangiectasia, NPAT), επίσης γνωστή ως πυρηνικός συνενεργοποιητής πρωτεϊνών της μεταγραφής ιστόνης, είναι ένας μεταγραφικός παράγοντας που ενεργοποιεί τη μεταγραφή του γονιδίου ιστόνης στα χρωμοσώματα 1 και 6 των ανθρώπινων κυττάρων. H NPAT είναι επίσης ένα υπόστρωμα της κυκλίνης E-Cdk2, το οποίο απαιτείται για τη μετάβαση μεταξύ της φάσης G1 και της φάσης S. Το NPAT ενεργοποιεί την έκφραση του γονιδίου ιστόνης μόνο αφού έχει φωσφορυλιωθεί από την G1/S-Cdk κυκλίνη E-Cdk2 στην πρώιμη φάση S.[114] Αυτό δείχνει μια σημαντική ρυθμιστική σύνδεση μεταξύ του ελέγχου του κυτταρικού κύκλου και της σύνθεσης ιστόνης.
Ιστορικό
Οι ιστόνες ανακαλύφθηκαν το 1884 από τον Άλμπρεχτ Κόσελ.[115] Η λέξη "ιστόνη" χρονολογείται από τα τέλη του 19ου αιώνα και προέρχεται από τη γερμανική λέξη "Histon", μια λέξη αβέβαιης προέλευσης, ίσως από την αρχαία ελληνική ἵστημι (hístēmi, "κάνω στάση"). ή ἱστός.
Στις αρχές της δεκαετίας του 1960, πριν γίνουν γνωστοί οι τύποι των ιστονών και προτού οι ιστόνες ήταν γνωστό ότι διατηρούνται σε μεγάλο βαθμό σε ταξινομικά διαφορετικούς οργανισμούς, ο James F. Bonner και οι συνεργάτες του ξεκίνησαν μια μελέτη αυτών των πρωτεϊνών που ήταν γνωστό ότι συνδέονται στενά με το DNA στον πυρήνα ανώτερων οργανισμών.[116] Ο Bonner και ο μεταδιδακτορικός συνεργάτης του Ru Chih C. Huang έδειξαν ότι η απομονωμένη χρωματίνη δεν θα υποστήριζε τη μεταγραφή RNA στον δοκιμαστικό σωλήνα, αλλά εάν οι ιστόνες εξάγονταν από τη χρωματίνη, το RNA θα μπορούσε να μεταγραφεί από το υπόλοιπο DNA.[117] Η εργασία τους έγινε κλασική αναφορά.[118] Ο Paul T'so και ο James Bonner είχαν συγκαλέσει ένα Παγκόσμιο Συνέδριο για τη Χημεία και τη Βιολογία των Ιστόνης το 1964, στο οποίο κατέστη σαφές ότι δεν υπήρχε συναίνεση για τον αριθμό των ειδών ιστόνης και ότι κανείς δεν ήξερε πώς θα συγκρίνονται όταν απομονωθεί από διαφορετικούς οργανισμούς.[119][116] Ο Bonner και οι συνεργάτες του ανέπτυξαν στη συνέχεια μεθόδους για τον διαχωρισμό κάθε τύπου ιστόνης, καθάρισαν μεμονωμένες ιστόνες, συνέκριναν συνθέσεις αμινοξέων στην ίδια ιστόνη από διαφορετικούς οργανισμούς και συνέκριναν αλληλουχίες αμινοξέων της ίδιας ιστόνης από διαφορετικούς οργανισμούς σε συνεργασία με τον Emil Smith από το UCLA.[120] Για παράδειγμα, βρήκαν ότι η αλληλουχία Histone IV διατηρείται σε μεγάλο βαθμό μεταξύ του αρακά και του θύμου μόσχου.[120] Ωστόσο, η εργασία τους για τα βιοχημικά χαρακτηριστικά μεμονωμένων ιστονών δεν αποκάλυψε πώς οι ιστόνες αλληλεπιδρούσαν μεταξύ τους ή με το DNA στο οποίο ήταν στενά συνδεδεμένες.[119]
Επίσης στη δεκαετία του 1960, ο Vincent Allfrey και ο Alfred Mirsky είχαν προτείνει, με βάση τις αναλύσεις τους για τις ιστόνες, ότι η ακετυλίωση και η μεθυλίωση των ιστονών θα μπορούσαν να παρέχουν έναν μεταγραφικό μηχανισμό ελέγχου, αλλά δεν είχαν διαθέσιμο το είδος της λεπτομερούς ανάλυσης που οι μετέπειτα ερευνητές ήταν σε θέση να δείξουν πώς μια τέτοια ρύθμιση θα μπορούσε να είναι ειδική για το γονίδιο.[121] Μέχρι τις αρχές της δεκαετίας του 1990, οι ιστόνες απορρίπτονταν από τους περισσότερους ως αδρανές υλικό συσκευασίας για το ευκαρυωτικό πυρηνικό DNA, μια άποψη που βασίζεται εν μέρει στα μοντέλα του Mark Ptashne και άλλων, οι οποίοι πίστευαν ότι η μεταγραφή ενεργοποιήθηκε από αλληλεπιδράσεις πρωτεΐνης-DNA και πρωτεϊνών - πρωτεϊνών σε γυμνά εκμαγεία DNA σε μεγάλο βαθμό, όπως συμβαίνει στα βακτήρια.
Κατά τη δεκαετία του 1980, ο Yahli Lorch και ο Roger Kornberg[122] έδειξαν ότι ένα νουκλεόσωμα σε έναν πυρήνα προαγωγέα εμποδίζει την έναρξη της μεταγραφής in vitro, και ο Michael Grunstein[123] έδειξε ότι οι ιστόνες καταστέλλουν τη μεταγραφή in vivo, οδηγώντας στην ιδέα του νουκλεοσώματος ως γενικού γονιδιακού καταστολέα. Η ανακούφιση από την καταστολή πιστεύεται ότι περιλαμβάνει τόσο την τροποποίηση ιστόνης όσο και τη δράση των συμπλεγμάτων αναδιαμόρφωσης της χρωματίνης. Οι Vincent Allfrey και Alfred Mirsky είχαν προτείνει νωρίτερα έναν ρόλο τροποποίησης ιστόνης στη μεταγραφική ενεργοποίηση,[124] να θεωρείται ως μοριακή εκδήλωση της επιγενετικής. Ο Michael Grunstein [125] και ο Ντέιβιντ Άλις [126] βρήκαν υποστήριξη για αυτήν την πρόταση, όσον αφορά τη σημασία της ακετυλίωσης ιστόνης για τη μεταγραφή σε ζυμομύκητες και τη δραστηριότητα του μεταγραφικού ενεργοποιητή Gcn5 ως ακετυλομεταφοράσης ιστόνης.
Η ανακάλυψη της ιστόνης H5 φαίνεται να χρονολογείται από τη δεκαετία του 1970,[127] και τώρα θεωρείται ισομορφή της ιστόνης Η1.[2][4][5][6]
Παραπομπές
Εξωτερικοί σύνδεσμοι
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
