Μεταγραφή (βιολογία)
διεργασία που αφορά την αντιγραφή ενός τμήματος του DNA σε RNA From Wikipedia, the free encyclopedia
Remove ads
Remove ads
Μεταγραφή είναι η διαδικασία αντιγραφής ενός τμήματος του DNA στο RNA με σκοπό την γονιδιακή έκφραση. Ορισμένα τμήματα του DNA μεταγράφονται σε μόρια RNA που μπορούν να κωδικοποιήσουν πρωτεΐνες, που ονομάζονται αγγελιοφόρο RNA (mRNA). Άλλα τμήματα του DNA μεταγράφονται σε μόρια RNA που ονομάζονται μη κωδικοποιητικά RNA (non-coding RNAs, ncRNAs). Τόσο το DNA όσο και το RNA είναι νουκλεϊκά οξέα, τα οποία χρησιμοποιούν ζεύγη βάσεων των νουκλεοτιδίων ως συμπληρωματική γλώσσα. Κατά τη μεταγραφή, μια αλληλουχία DNA διαβάζεται από μία RNA πολυμεράση, που παράγει έναν συμπληρωματικό, αντιπαράλληλο κλώνο RNA που ονομάζεται πρωτογενές μεταγράφημα (primary transcript). Στην ιολογία, ο όρος μεταγραφή χρησιμοποιείται όταν αναφέρεται στη σύνθεση mRNA από ένα μόριο ιικού RNA. Το γονιδίωμα πολλών ιών RNA[α] αποτελείται από αρνητικό νοηματικό RNA που λειτουργεί ως πρότυπο για νοηματικά RNA αγγελιαφόρου ιού - ένα απαραίτητο βήμα στη σύνθεση ιικών πρωτεϊνών που απαιτούνται για ιική αντιγραφή. Αυτή η διαδικασία καταλύεται από μια ιική πολυμεράση RNA εξαρτώμενη από RNA.[1]
Remove ads
Υπόβαθρο
Μια μονάδα μεταγραφής DNA που κωδικοποιεί μια πρωτεΐνη μπορεί να περιέχει τόσο μια κωδικοποιητική αλληλουχία, η οποία θα μεταφραστεί στην πρωτεΐνη, όσο και ρυθμιστικές αλληλουχίες, που κατευθύνουν και ρυθμίζουν τη σύνθεση αυτής της πρωτεΐνης. Η ρυθμιστική αλληλουχία πριν την ανάντη από την κωδικοποιητική αλληλουχία ονομάζεται 5' αμετάφραστη περιοχή (five prime untranslated region, 5'UTR). η ακολουθία μετά την κατάντη από την κωδικοποιητική ακολουθία ονομάζεται 3' αμετάφραστη περιοχή (three prime untranslated region, 3'UTR).[2] Σε αντίθεση με την αντιγραφή του DNA, η μεταγραφή έχει ως αποτέλεσμα ένα συμπλήρωμα RNA που περιλαμβάνει το νουκλεοτίδιο ουρακίλη (U) σε όλες τις περιπτώσεις όπου η θυμίνη (Τ) θα είχε εμφανιστεί σε ένα συμπλήρωμα DNA.[3] Μόνο ένας από τους δύο κλώνους DNA χρησιμεύει ως πρότυπο για τη μεταγραφή. Ο αντινοηματικός κλώνος του DNA διαβάζεται από την RNA πολυμεράση από το 3' άκρο προς το 5' άκρο κατά τη διάρκεια της μεταγραφής (3' → 5'). Το συμπληρωματικό RNA δημιουργείται προς την αντίθετη κατεύθυνση, προς την κατεύθυνση 5' → 3', ταιριάζοντας με την αλληλουχία του νοηματικού κλώνου εκτός από την εναλλαγή της ουρακίλης για τη θυμίνη. Αυτή η κατευθυντικότητα οφείλεται στο ότι η RNA πολυμεράση μπορεί να προσθέσει νουκλεοτίδια μόνο στο 3' άκρο της αναπτυσσόμενης αλυσίδας mRNA. Αυτή η χρήση μόνο του 3' → 5' κλώνου DNA εξαλείφει την ανάγκη για τα θραύσματα του Οκαζάκι που φαίνονται στην αντιγραφή του DNA.[2] Αυτό αφαιρεί επίσης την ανάγκη για ένα RNA εκκινητή για την έναρξη της σύνθεσης RNA, όπως συμβαίνει στην αντιγραφή του DNA. Ο νοηματικός κλώνος του DNA ονομάζεται κωδικοποιητικός κλώνος, επειδή η αλληλουχία του είναι η ίδια με το νεοδημιουργημένο μεταγράφημα RNA (εκτός από την υποκατάσταση της ουρακίλης αντί της θυμίνης). Αυτός είναι ο κλώνος που χρησιμοποιείται κατά σύμβαση όταν παρουσιάζεται μια αλληλουχία DNA.[4] Η μεταγραφή έχει ορισμένους μηχανισμούς διόρθωσης, αλλά είναι λιγότεροι και λιγότερο αποτελεσματικοί από τους ελέγχους για την αντιγραφή του DNA. Ως αποτέλεσμα, η μεταγραφή έχει χαμηλότερη πιστότητα αντιγραφής από την αντιγραφή του DNA.[5]
Remove ads
Βασικά βήματα
Η μεταγραφή χωρίζεται σε έναρξη, διαφυγή προαγωγέα, επιμήκυνση και τερματισμός.[6]
Ρύθμιση για μεταγραφή
Ενισχυτές, παράγοντες μεταγραφής, σύμπλοκο μεσολαβητή και βρόχοι DNA στη μεταγραφή θηλαστικών

Η ρύθμιση για τη μεταγραφή σε θηλαστικά ρυθμίζεται από πολλά cis ρυθμιστικά στοιχεία, συμπεριλαμβανομένων των εγγύς στοιχείων του προαγωγέα που βρίσκονται κοντά στις θέσεις έναρξης της μεταγραφής των γονιδίων. Οι βασικοί προαγωγείς σε συνδυασμό με τους γενικούς παράγοντες μεταγραφής είναι επαρκείς για να κατευθύνουν την έναρξη της μεταγραφής, αλλά γενικά έχουν χαμηλή βασική δραστηριότητα.[7] Άλλες σημαντικές ρυθμιστικές μονάδες cis εντοπίζονται σε περιοχές DNA που είναι απομακρυσμένες από τις θέσεις έναρξης της μεταγραφής. Αυτές περιλαμβάνουν ενισχυτές, αποσιωπητές, μονωτές και στοιχεία πρόσδεσης.[8] Μεταξύ αυτών των πολλών στοιχείων, οι ενισχυτές και οι σχετικοί παράγοντες μεταγραφής έχουν πρωταγωνιστικό ρόλο στην έναρξη της γονιδιακής μεταγραφής.[9] Ένας ενισχυτής εντοπισμένος σε μια περιοχή DNA μακριά από τον προαγωγέα ενός γονιδίου μπορεί να έχει πολύ μεγάλη επίδραση στη μεταγραφή του γονιδίου, με ορισμένα γονίδια να υφίστανται έως και 100 φορές αυξημένη μεταγραφή λόγω ενός ενεργοποιημένου ενισχυτή.[10]
Οι ενισχυτές είναι περιοχές του γονιδιώματος που είναι κύρια γονιδιακά ρυθμιστικά στοιχεία. Οι ενισχυτές ελέγχουν προγράμματα μεταγραφής γονιδίων ειδικά για τον κυτταρικό τύπο, τις περισσότερες φορές κάνοντας βρόχους σε μεγάλες αποστάσεις για να έρθουν σε φυσική εγγύτητα με τους προαγωγείς των γονιδίων-στόχων τους.[11] Ενώ υπάρχουν εκατοντάδες χιλιάδες περιοχές DNA ενισχυτών,[12] για έναν συγκεκριμένο τύπο ιστού μόνο ειδικοί ενισχυτές έρχονται σε εγγύτητα με τους προαγωγούς που ρυθμίζουν. Σε μια μελέτη των νευρώνων του φλοιού του εγκεφάλου, βρέθηκαν 24.937 βρόχοι, που φέρνουν ενισχυτές στους προαγωγείς-στόχους τους.[10] Πολλοί ενισχυτές, ο καθένας συχνά σε δεκάδες ή εκατοντάδες χιλιάδες νουκλεοτίδια απομακρυσμένος από τα γονίδια-στόχους τους, συνδέονται με τους προαγωγείς του γονιδίου στόχου τους και μπορούν να συντονιστούν μεταξύ τους για τον έλεγχο της μεταγραφής του κοινού γονιδίου στόχου τους.[11] Η σχηματική απεικόνιση σε αυτό το τμήμα δείχνει έναν ενισχυτή να κάνει βρόχο για να έρθει σε στενή φυσική εγγύτητα με τον προαγωγέα ενός γονιδίου στόχου. Ο βρόχος σταθεροποιείται από ένα διμερές μιας πρωτεΐνης σύνδεσης (π.χ. διμερές του CTCF ή YY1), με ένα μέλος του διμερούς αγκυρωμένο στο μοτίβο δέσμευσής του στον ενισχυτή και το άλλο μέλος αγκυρωμένο στη σύνδεσή του μοτίβου στον προαγωγέα (που αντιπροσωπεύεται από τα κόκκινα ζιγκ-ζαγκ στην εικόνα).[13] Υπάρχουν αρκετοί μεταγραφικοί παράγοντες ειδικής λειτουργίας των κυττάρων (περίπου 1.600 μεταγραφικοί παράγοντες σε ένα ανθρώπινο κύτταρο [14]) που συνδέονται γενικά με συγκεκριμένα μοτίβα σε έναν ενισχυτή [15] Και ένας μικρός συνδυασμός αυτών των μεταγραφικών παραγόντων που συνδέονται με τον ενισχυτή, όταν έρχονται κοντά σε έναν προαγωγέα μέσω βρόχου DNA, διέπουν το επίπεδο μεταγραφής του γονιδίου στόχου. Ο διαμεσολαβητής (ένα σύμπλοκο που αποτελείται συνήθως από περίπου 26 πρωτεΐνες σε μια δομή αλληλεπίδρασης) επικοινωνεί με ρυθμιστικά σήματα με τους μεταγραφικούς παράγοντες που δεσμεύονται στο DNA του ενισχυτή απευθείας στο ένζυμο RNA πολυμεράσης II (pol II) που είναι συνδεδεμένο με τον προαγωγέα.[16] Οι ενισχυτές, όταν είναι ενεργοί, μεταγράφονται γενικά και από τους δύο κλώνους του DNA με τις RNA πολυμεράσες που δρουν σε δύο διαφορετικές κατευθύνσεις, παράγοντας δύο ενισχυτικά RNAs (enhancer RNAs, eRNAs) όπως απεικονίζεται στο σχήμα.[17] Ένας ανενεργός ενισχυτής μπορεί να δεσμεύεται από έναν ανενεργό παράγοντα μεταγραφής. Η φωσφορυλίωση του μεταγραφικού παράγοντα μπορεί να τον ενεργοποιήσει και αυτός ο ενεργοποιημένος παράγοντας μεταγραφής μπορεί στη συνέχεια να ενεργοποιήσει τον ενισχυτή στον οποίο είναι συνδεδεμένος (βλ. το μικρό κόκκινο αστέρι που αντιπροσωπεύει τη φωσφορυλίωση του μεταγραφικού παράγοντα που συνδέεται με τον ενισχυτή στην εικόνα).[18] Ένας ενεργοποιημένος ενισχυτής ξεκινά τη μεταγραφή του RNA του πριν ενεργοποιήσει τη μεταγραφή του αγγελιαφόρου RNA από το γονίδιο στόχο του.[19]
Μεθυλίωση και απομεθυλίωση νησίδας CpG

Η ρύθμιση της μεταγραφής στο 60% περίπου των προαγωγέων ελέγχεται επίσης με μεθυλίωση κυτοσινών εντός των δινουκλεοτιδίων CpG (όπου η 5' κυτοσίνη ακολουθείται από 3' γουανίνη ή θέσεις CpG). Η 5-μεθυλκυτοσίνη (5-mC) είναι μια μεθυλιωμένη μορφή της βάσης κυτοσίνη του DNA (βλ. Εικόνα). Η 5-mC είναι ένας δείκτης επιγενετικής που βρίσκεται κυρίως στις θέσεις CpG. Περίπου 28 εκατομμύρια δινουκλεοτίδια CpG εμφανίζονται στο ανθρώπινο γονιδίωμα.[20] Στους περισσότερους ιστούς θηλαστικών, κατά μέσο όρο, το 70% έως 80% των κυτοσινών CpG είναι μεθυλιωμένες (σχηματίζοντας 5-methylCpG ή 5-mCpG).[21] Ωστόσο, οι μη μεθυλιωμένες κυτοσίνες εντός των αλληλουχιών 5'κυτοσίνης-γουανίνης 3' εμφανίζονται συχνά σε ομάδες, που ονομάζονται νησίδες CpG, σε ενεργούς προαγωγείς. Περίπου το 60% των αλληλουχιών προαγωγέα έχουν νησίδα CpG, ενώ μόνο το 6% περίπου των αλληλουχιών ενισχυτών έχουν νησίδα CpG.[22] Οι νησίδες CpG αποτελούν ρυθμιστικές αλληλουχίες, καθώς εάν οι νησίδες CpG μεθυλιωθούν στον προαγωγέα ενός γονιδίου, αυτό μπορεί να μειώσει ή να αποσιωπήσει τη μεταγραφή του γονιδίου.[23] Η μεθυλίωση του DNA ρυθμίζει τη γονιδιακή μεταγραφή μέσω αλληλεπίδρασης με πρωτεΐνες του τομέα δέσμευσης μεθυλίου (methyl binding domain, MBD), όπως MeCP2, MBD1 και MBD2. Αυτές οι πρωτεΐνες MBD συνδέονται πιο ισχυρά με υψηλά μεθυλιωμένες νησίδες CpG.[24] Αυτές οι πρωτεΐνες MBD έχουν τόσο μια περιοχή δέσμευσης μεθυλ-CpG όσο και μια περιοχή καταστολής μεταγραφής.[24] Συνδέονται με μεθυλιωμένο DNA και καθοδηγούν ή κατευθύνουν σύμπλοκα πρωτεϊνών με δράση αναδιαμόρφωσης χρωματίνης ή/και τροποποιητικής ιστόνης σε μεθυλιωμένες νησίδες CpG. Οι πρωτεΐνες MBD καταστέλλουν γενικά την τοπική χρωματίνη, όπως καταλύοντας την εισαγωγή των κατασταλτικών σημαδιών ιστόνης ή δημιουργώντας ένα συνολικό κατασταλτικό περιβάλλον χρωματίνης μέσω αναδιαμόρφωσης νουκλεοσώματος και αναδιοργάνωσης της χρωματίνης.[24]

Όπως σημειώθηκε στην προηγούμενη ενότητα, οι παράγοντες μεταγραφής είναι πρωτεΐνες που συνδέονται με συγκεκριμένες αλληλουχίες DNA προκειμένου να ρυθμίσουν την έκφραση ενός γονιδίου. Η αλληλουχία δέσμευσης για έναν παράγοντα μεταγραφής στο DNA έχει συνήθως μήκος περίπου 10 ή 11 νουκλεοτιδίων. Όπως συνοψίστηκε το 2009, οι Vaquerizas κ.α. υποδεικνύουν ότι υπάρχουν περίπου 1.400 διαφορετικοί παράγοντες μεταγραφής που κωδικοποιούνται στο ανθρώπινο γονιδίωμα από γονίδια που αποτελούν περίπου το 6% όλων των γονιδίων που κωδικοποιούν ανθρώπινη πρωτεΐνη.[25] Περίπου το 94% των θέσεων δέσμευσης μεταγραφικού παράγοντα (transcription factor binding sites, TFBS) που σχετίζονται με γονίδια που ανταποκρίνονται στο σήμα εμφανίζονται σε ενισχυτές, ενώ μόνο περίπου το 6% αυτών των TFBS εμφανίζονται σε προαγωγείς.[15] Η πρωτεΐνη EGR1 είναι ένας ιδιαίτερος μεταγραφικός παράγοντας που είναι σημαντικός για τη ρύθμιση της μεθυλίωσης των νησίδων CpG. Μια θέση δέσμευσης μεταγραφικού παράγοντα EGR1 εντοπίζεται συχνά σε αλληλουχίες ενισχυτή ή προαγωγέα.[26] Υπάρχουν περίπου 12.000 θέσεις δέσμευσης για το EGR1 στο γονιδίωμα των θηλαστικών και περίπου οι μισές θέσεις δέσμευσης EGR1 βρίσκονται σε προαγωγείς και οι μισές σε ενισχυτές.[26] Η δέσμευση του EGR1 στη θέση δέσμευσης του DNA στόχου είναι μη ευαίσθητη στη μεθυλίωση της κυτοσίνης στο DNA.[26] Ενώ μόνο μικρές ποσότητες πρωτεΐνης μεταγραφικού παράγοντα EGR1 είναι ανιχνεύσιμες σε κύτταρα που δεν διεγείρονται, η μετάφραση του γονιδίου EGR1 σε πρωτεΐνη μία ώρα μετά τη διέγερση είναι δραστικά αυξημένη.[27] Η παραγωγή πρωτεϊνών του μεταγραφικού παράγοντα EGR1, σε διάφορους τύπους κυττάρων, μπορεί να διεγερθεί από αυξητικούς παράγοντες, νευροδιαβιβαστές, ορμόνες, άγχος και τραυματισμούς.[27] Στον εγκέφαλο, όταν ενεργοποιούνται οι νευρώνες, οι πρωτεΐνες EGR1 ρυθμίζονται προς τα πάνω και συνδέονται με (στρατολογούν) τα προϋπάρχοντα ένζυμα TET1 που παράγονται σε υψηλές ποσότητες στους νευρώνες. Τα ένζυμα ΤΕΤ μπορούν να καταλύσουν την απομεθυλίωση της 5-μεθυλκυτοσίνης. Όταν οι μεταγραφικοί παράγοντες EGR1 φέρνουν τα ένζυμα TET1 σε θέσεις δέσμευσης EGR1 σε προαγωγείς, τα ένζυμα TET μπορούν να απομεθυλιώσουν τις μεθυλιωμένες νησίδες CpG σε αυτούς τους προαγωγείς. Κατά την απομεθυλίωση, αυτοί οι προαγωγείς μπορούν στη συνέχεια να ξεκινήσουν τη μεταγραφή των γονιδίων-στόχων τους. Εκατοντάδες γονίδια σε νευρώνες εκφράζονται διαφορετικά μετά την ενεργοποίηση νευρώνων μέσω της στρατολόγησης EGR1 του TET1 σε μεθυλιωμένες ρυθμιστικές αλληλουχίες στους προαγωγείς τους.[26] Η μεθυλίωση των προαγωγέων μεταβάλλεται επίσης ως απόκριση στα σήματα. Οι τρεις μεθυλομεταφοράσες των θηλαστικών (DNMT1, DNMT3A και DNMT3B) καταλύουν την προσθήκη μεθυλομάδων σε κυτοσίνες στο DNA. Ενώ το DNMT1 είναι μεθυλομεταφοράση συντήρησης, το DNMT3A και το DNMT3B μπορούν να πραγματοποιήσουν νέες μεθυλιώσεις. Υπάρχουν επίσης δύο ισομορφές ματίσματος πρωτεϊνών που παράγονται από το γονίδιο DNMT3A: οι μεθυλομεταφοράσες του DNA DNMT3A1 και DNMT3A2.[28] Η ισομορφή ματίσματος DNMT3A2 συμπεριφέρεται όπως το προϊόν ενός κλασικού άμεσου-πρώιμου γονιδίου και, για παράδειγμα, παράγεται ισχυρά και παροδικά μετά από νευρωνική ενεργοποίηση.[29] Όπου η ισομορφή DNMT3A2 μεθυλομεταφοράσης DNA δεσμεύεται και προσθέτει μεθυλικές ομάδες στις κυτοσίνες φαίνεται να προσδιορίζεται από τροποποιήσεις ιστόνης μετά τη μετάφραση.[30][31][32] Από την άλλη πλευρά, η νευρική ενεργοποίηση προκαλεί αποικοδόμηση του DNMT3A1 που συνοδεύεται από μειωμένη μεθυλίωση τουλάχιστον ενός αξιολογημένου στοχευμένου προαγωγέα.[33]
Έναρξη
Τα στοιχεία της ρυθμιστικής αλληλουχίας (κίτρινο) στην αρχή ενός γονιδίου που κωδικοποιεί ευκαρυωτική πρωτεΐνη, μπορεί να είναι αμέσως ανάντη του ανοιχτού πλαισίου ανάγνωσης (ORF, κόκκινο) ή πολλές κιλοβάσεις μακριά (ανάντη ή κατάντη). Οι περιοχές του προαγωγέα και του ενισχυτή ρυθμίζουν προς τα πάνω (και οι αποσιωπητές ρυθμίζουν προς τα κάτω) τη μεταγραφή από DNA σε mRNA. Οι 5' και 3' μη μεταφρασμένες περιοχές αυτού του mRNA (UTR, γαλάζιο) στη συνέχεια ρυθμίζουν τη μετάφραση στο τελικό προϊόν πρωτεΐνης.[34]
Κατά την έναρξη της μεταγραφής, οι πρωτεΐνες (σκούρο γκρι ημικύκλια) που είναι συνδεδεμένες με το DNA μπορούν να έρθουν σε εγγύτητα μεταξύ τους, καθώς το DNA που παρεμβάλλεται μπορεί να επαναφέρει τον εαυτό του. Με αυτόν τον τρόπο, ο βασικός μηχανισμός μεταγραφής μπορεί να αλληλεπιδράσει με απομακρυσμένους ενεργοποιητές και καταστολείς πολλές κιλοβάσεις ανάντη ή κατάντη του ανοιχτού πλαισίου ανάγνωσης.[34]
Η μεταγραφή ξεκινά με την RNA πολυμεράση και έναν ή περισσότερους γενικούς μεταγραφικούς παράγοντες που συνδέονται με μια αλληλουχία DNA προαγωγέα για να σχηματίσουν ένα κλειστό σύμπλεγμα RNA πολυμεράσης-προαγωγέα. Στο κλειστό σύμπλεγμα, το DNA του προαγωγέα εξακολουθεί να είναι πλήρως δίκλωνο.[6] Η RNA πολυμεράση, υποβοηθούμενη από έναν ή περισσότερους γενικούς μεταγραφικούς παράγοντες, στη συνέχεια ξετυλίγει περίπου 14 ζεύγη βάσεων DNA για να σχηματίσει ένα ανοιχτό σύμπλεγμα RNA πολυμεράσης-προαγωγέα. Στο ανοιχτό σύμπλεγμα, το DNA του προαγωγέα είναι εν μέρει ξετυλιγμένο και μονόκλωνο. Το εκτεθειμένο, μονόκλωνο DNA αναφέρεται ως φυσαλίδα μεταγραφής (transcription bubble).[6] Η RNA πολυμεράση, υποβοηθούμενη από έναν ή περισσότερους γενικούς παράγοντες μεταγραφής, στη συνέχεια επιλέγει μια θέση έναρξης μεταγραφής στη φυσαλίδα μεταγραφής, δεσμεύεται σε ένα αρχικό τριφωσφορικό νουκλεοζίτη και ένα επεκτεινόμενο τριφωσφορικό νουκλεοζίτη (ή ένα σύντομο εκκινητή RNA και ένα επεκτεινόμενο NTP) συμπληρωματικό στην αλληλουχία θέσης έναρξης της μεταγραφής και καταλύει το σχηματισμό δεσμού για να δώσει ένα αρχικό προϊόν RNA.[6] Στα βακτήρια, το ολοένζυμο RNA πολυμεράσης αποτελείται από πέντε υπομονάδες: 2 α υπομονάδες, 1 β υπομονάδα, 1 β' υπομονάδα και 1 ω υπομονάδα. Στα βακτήρια, υπάρχει ένας γενικός παράγοντας μεταγραφής RNA γνωστός ως παράγοντας σίγμα. Το κεντρικό ένζυμο RNA πολυμεράσης συνδέεται με τον βακτηριακό γενικό παράγοντα μεταγραφής (σίγμα) για να σχηματίσει το ολοένζυμο πολυμεράσης RNA και στη συνέχεια συνδέεται με έναν προαγωγέα.[6] (Η RNA πολυμεράση ονομάζεται ολοένζυμο όταν η υπομονάδα σίγμα συνδέεται με το κύριο ένζυμο που αποτελείται από 2 α υπομονάδες, 1 β υπομονάδα, 1 β' υπομονάδα μόνο). Σε αντίθεση με τους ευκαρυώτες, το νουκλεοτίδιο έναρξης του εκκολαπτόμενου βακτηριακού mRNA δεν καλύπτεται με ένα τροποποιημένο νουκλεοτίδιο γουανίνης. Το νουκλεοτίδιο έναρξης των βακτηριακών μεταγραφών φέρει ένα 5' τριφωσφορικό (5'-PPP), το οποίο μπορεί να χρησιμοποιηθεί για χαρτογράφηση θέσεων έναρξης μεταγραφής σε όλο το γονιδίωμα.[35] Στα αρχαία και τους ευκαρυώτες, η RNA πολυμεράση περιέχει ομόλογες υπομονάδες σε καθεμία από τις πέντε υπομονάδες RNA πολυμεράσης στα βακτήρια και περιέχει επίσης επιπλέον υπομονάδες. Στα αρχαία και στους ευκαρυώτες, οι λειτουργίες του βακτηριακού γενικού μεταγραφικού παράγοντα σίγμα εκτελούνται από πολλαπλούς γενικούς μεταγραφικούς παράγοντες που συνεργάζονται.[6] Στα αρχαία, υπάρχουν τρεις γενικοί μεταγραφικοί παράγοντες: TBP, TFB και TFE. Στους ευκαρυώτες, στην εξαρτώμενη από RNA πολυμεράση II μεταγραφή, υπάρχουν έξι γενικοί μεταγραφικοί παράγοντες: TFIIA, TFIIB (ένα ορθόλογος του αρχαϊκού TFB), TFIID (ένας παράγοντας πολλαπλών υπομονάδων στον οποίο η βασική υπομονάδα, TBP, είναι ένας ορθόλογος της αρχαϊκής TBP), TFIIE (ένας ορθόλογος της αρχαϊκής TFE), TFIIF και TFIIH. Το TFIID είναι το πρώτο συστατικό που συνδέεται με το DNA λόγω δέσμευσης της TBP, ενώ το TFIIH είναι το τελευταίο συστατικό που στρατολογείται. Στα αρχαία και στους ευκαρυώτες, το κλειστό σύμπλεγμα RNA πολυμεράσης-προαγωγέα αναφέρεται συνήθως ως σύμπλεγμα προεκκίνησης.[36] Η έναρξη της μεταγραφής ρυθμίζεται από επιπρόσθετες πρωτεΐνες, γνωστές ως ενεργοποιητές και καταστολείς (repressors), και, σε ορισμένες περιπτώσεις, σχετιζόμενες με συνενεργοποιητές (coactivators) ή συνκαταστολείς (corepressors), οι οποίοι ρυθμίζουν το σχηματισμό και τη λειτουργία του συμπλέγματος έναρξης μεταγραφής.[6]
Διαφυγή προαγωγέων (υποκινητών)
Αφού συντεθεί ο πρώτος δεσμός, η RNA πολυμεράση πρέπει να διαφύγει από τον προαγωγέα (υποκινητή). Κατά τη διάρκεια αυτής της περιόδου υπάρχει μια τάση απελευθέρωσης του μεταγραφήματος RNA και παραγωγής περικομμένων μεταγραφημάτων. Αυτό ονομάζεται ανεπιτυχής έναρξη (abortive initiation) και είναι κοινή τόσο για ευκαρυώτες όσο και για προκαρυώτες.[37] Η ανεπιτυχής έναρξη συνεχίζει να συμβαίνει έως ότου συντεθεί ένα προϊόν RNA μήκους κατωφλίου περίπου 10 νουκλεοτιδίων, οπότε λαμβάνει χώρα διαφυγή προαγωγέα και σχηματίζεται ένα σύμπλοκο επιμήκυνσης μεταγραφής. Μηχανιστικά, η διαφυγή του προαγωγέα λαμβάνει χώρα μέσω του τσαλακώματος του DNA (DNA scrunching), παρέχοντας την ενέργεια που απαιτείται για το σπάσιμο των αλληλεπιδράσεων μεταξύ του ολοενζύμου RNA πολυμεράσης και του προαγωγέα.[38] Στα βακτήρια, θεωρούνταν ιστορικά ότι ο παράγοντας σίγμα απελευθερώνεται οπωσδήποτε μετά την κάθαρση του προαγωγέα. Αυτή η θεωρία ήταν γνωστή ως πρότυπο υποχρεωτικής απελευθέρωσης. Ωστόσο, μεταγενέστερα δεδομένα έδειξαν ότι κατά και μετά την εκκαθάριση του προαγωγέα, ο παράγοντας σίγμα απελευθερώνεται σύμφωνα με ένα στοχαστικό πρότυπο γνωστό ως πρότυπο στοχαστικής απελευθέρωσης.[39] Στους ευκαρυώτες, σε έναν εξαρτώμενο από RNA πολυμεράση II προαγωγέα, κατά την κάθαρση του προαγωγέα, ο TFIIH φωσφορυλιώνει τη σερίνη 5 στην καρβοξυτελική περιοχή της RNA πολυμεράσης II, οδηγώντας στη στρατολόγηση του ενζύμου κάλυψης (capping enzyme, CE).[40][41] Ο ακριβής μηχανισμός του τρόπου με τον οποίο το CE επάγει την κάθαρση του προαγωγέα στους ευκαρυώτες δεν είναι ακόμη γνωστός.
Επιμήκυνση
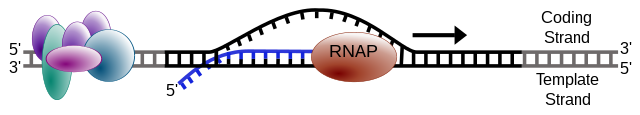
Ένας κλώνος του DNA, ο κλώνος-εκμαγείο (ή μη κωδικοποιητικός κλώνος), χρησιμοποιείται ως πρότυπο για τη σύνθεση RNA. Καθώς προχωρά η μεταγραφή, η πολυμεράση RNA διασχίζει τον κλώνο του εκμαγείου και χρησιμοποιεί τη συμπληρωματικότητα του ζεύγους βάσεων με το πρότυπο DNA για να δημιουργήσει ένα αντίγραφο RNA (το οποίο επιμηκύνεται κατά τη διάρκεια της διέλευσης). Αν και η RNA πολυμεράση διασχίζει τον κλώνο του εκμαγείου από 3' → 5', ο κωδικοποιητικός (μη-πρότυπος) κλώνος και το νεοσχηματισμένο RNA μπορούν επίσης να χρησιμοποιηθούν ως σημεία αναφοράς, επομένως η μεταγραφή μπορεί να περιγραφεί ότι λαμβάνει χώρα κατά την κατεύθυνση 5' → 3'. Αυτό παράγει ένα μόριο RNA από το 5' → 3', ένα ακριβές αντίγραφο του κωδικοποιητικού κλώνου (εκτός από το ότι η θυμίνη αντικαθίσταται με ουρακίλη, και τα νουκλεοτίδια αποτελούνται από ένα σάκχαρο ριβόζης (με 5 άνθρακες), ενώ το DNA έχει δεοξυριβόζη (ένα λιγότερο άτομο οξυγόνου στο φωσφορικό σκελετό του σακχάρου του).[3] Η μεταγραφή του mRNA μπορεί να περιλαμβάνει πολλές RNA πολυμεράσες σε ένα μόνο πρότυπο DNA και πολλούς γύρους μεταγραφής (ενίσχυση συγκεκριμένου mRNA), έτσι πολλά μόρια mRNA μπορούν να παραχθούν γρήγορα από ένα μόνο αντίγραφο ενός γονιδίου. Οι χαρακτηριστικοί ρυθμοί επιμήκυνσης σε προκαρυώτες και ευκαρυώτες είναι περίπου 10-100 nts/s.[42] Στους ευκαρυώτες, ωστόσο, τα νουκλεοσώματα δρουν ως κύριοι φραγμοί στη μεταγραφή πολυμερασών κατά την επιμήκυνση της μεταγραφής.[43][44] Σε αυτούς τους οργανισμούς, η παύση που προκαλείται από τα νουκλεοσώματα μπορεί να ρυθμιστεί από παράγοντες επιμήκυνσης μεταγραφής όπως το TFIIS.[44] Η επιμήκυνση περιλαμβάνει επίσης έναν μηχανισμό διόρθωσης που μπορεί να αντικαταστήσει τις εσφαλμένα ενσωματωμένες βάσεις. Στους ευκαρυώτες, αυτό μπορεί να αντιστοιχεί με μικρές παύσεις κατά τη διάρκεια της μεταγραφής που επιτρέπουν τη δέσμευση κατάλληλων παραγόντων επεξεργασίας RNA. Αυτές οι παύσεις μπορεί να είναι εγγενείς στην RNA πολυμεράση ή να οφείλονται στη δομή της χρωματίνης. Οι θραύσεις διπλού κλώνου σε ενεργά μεταγραμμένες περιοχές του DNA επιδιορθώνονται με ομόλογο ανασυνδυασμό κατά τη διάρκεια των φάσεων S και G2 του κυτταρικού κύκλου.[45][46] Εφόσον η μεταγραφή ενισχύει την προσβασιμότητα του DNA σε εξωγενείς χημικές ουσίες και εσωτερικούς μεταβολίτες που μπορούν να προκαλέσουν ανασυνδυασμογόνες βλάβες, ο ομόλογος ανασυνδυασμός μιας συγκεκριμένης αλληλουχίας DNA μπορεί να διεγείρεται έντονα από τη μεταγραφή.[47]
Τερματισμός
Τα βακτήρια χρησιμοποιούν δύο διαφορετικές στρατηγικές για τον τερματισμό της μεταγραφής – τερματισμό ανεξάρτητο από το Rho και τερματισμό εξαρτώμενο από το Rho. Στον ανεξάρτητο από το Rho τερματισμό της μεταγραφής, η μεταγραφή του RNA σταματά όταν το νεοσυντιθέμενο μόριο RNA σχηματίζει έναν πλούσιο σε G-C βρόχο φουρκέτας που ακολουθείται από μια σειρά U. Όταν σχηματίζεται η φουρκέτα, η μηχανική καταπόνηση σπάει τους ασθενείς δεσμούς rU-dA, γεμίζοντας τώρα το υβρίδιο DNA-RNA. Αυτό τραβάει το μεταγράφημα poly-U έξω από την ενεργό θέση της RNA πολυμεράσης, τερματίζοντας τη μεταγραφή. Στoν εξαρτώμενo από Rho τερματισμό, ο παράγοντας Rho, ένας πρωτεϊνικός παράγοντας, αποσταθεροποιεί την αλληλεπίδραση μεταξύ του εκμαγείου και του mRNA, απελευθερώνοντας έτσι το νεοσυντιθέμενο mRNA από το σύμπλεγμα επιμήκυνσης.[48] Ο τερματισμός της μεταγραφής στους ευκαρυώτες είναι λιγότερο κατανοητός από ότι στα βακτήρια, αλλά περιλαμβάνει διάσπαση του νέου μεταγραφήματος που ακολουθείται από ανεξάρτητη από το εκμαγείο προσθήκη αδενινών στο νέο 3' άκρο του, σε μια διαδικασία που ονομάζεται πολυαδενυλίωση.[49] Πέρα από τον τερματισμό από αλληλουχίες τερματισμού (που είναι μέρος ενός γονιδίου), η μεταγραφή μπορεί επίσης να χρειαστεί να τερματιστεί όταν αντιμετωπίζει καταστάσεις όπως βλάβη του DNA ή ενεργή διχάλα αντιγραφής (replication fork). Στα βακτήρια, η ATPάση στο γονίδιο μείωσης της συχνότητας μετάλλαξης (Mutation Frequency Decline, Mfd) μπορεί να αφαιρέσει μια πολυμεράση RNA που έχει σταματήσει σε μια βλάβη ανοίγοντας τον σφιγκτήρα της. Επιστρατεύει επίσης μηχανισμούς επιδιόρθωσης αποκοπής νουκλεοτιδίων για την αποκατάσταση της βλάβης. Το Mfd προτείνεται επίσης για την επίλυση των συγκρούσεων μεταξύ της αντιγραφής του DNA και της μεταγραφής.[50] Στους ευκαυρώτες, η ATPάση TTF2 βοηθά στην καταστολή της δράσης των RNAP I και II κατά τη διάρκεια της μίτωσης, αποτρέποντας σφάλματα στον χρωμοσωμικό διαχωρισμό.[51] Στα αρχαία, η Eta ATPάση προτείνεται ότι διαδραματίζει παρόμοιο ρόλο.[52]
Η μεταγραφή αυξάνει την ευαισθησία σε βλάβη του DNA
Η βλάβη του γονιδιώματος εμφανίζεται με υψηλή συχνότητα, η οποία εκτιμάται ότι κυμαίνεται μεταξύ δεκάδων και εκατοντάδων χιλιάδων βλαβών στο DNA που προκύπτουν σε κάθε κύτταρο κάθε μέρα.[53] Η διαδικασία μεταγραφής είναι μια κύρια πηγή βλάβης του DNA, λόγω του σχηματισμού ενδιάμεσων μονόκλωνων DNA που είναι ευάλωτα σε βλάβες.[53] Η ρύθμιση της μεταγραφής με διαδικασίες που χρησιμοποιούν επιδιόρθωση εκτομής βάσεων ή/και τοποϊσομερασών για την αποκοπή και την αναδιαμόρφωση του γονιδιώματος αυξάνει επίσης την τρωτότητα του DNA σε βλάβες.[53]
Remove ads
Ο ρόλος της RNA πολυμεράσης στις μετα-μεταγραφικές αλλαγές στο RNA

Η RNA πολυμεράση παίζει πολύ κρίσιμο ρόλο σε όλα τα στάδια, συμπεριλαμβανομένων των μετα-μεταγραφικών αλλαγών στο RNA.

Όπως φαίνεται στην εικόνα στα δεξιά, είναι προφανές ότι το CTD (C Terminal Domain) είναι μια ουρά που αλλάζει το σχήμα του. Αυτή η ουρά θα χρησιμοποιηθεί ως φορέας ματίσματος, κάλυψης και πολυαδενυλίωσης, όπως φαίνεται στην εικόνα στα αριστερά.[54]
Αναστολείς
Οι αναστολείς μεταγραφής μπορούν να χρησιμοποιηθούν ως αντιβιοτικά κατά, για παράδειγμα, παθογόνων βακτηρίων (αντιβακτηριακά) και μυκήτων (αντιμυκητιακά). Ένα παράδειγμα τέτοιου αντιβακτηριακού είναι η ριφαμπικίνη, η οποία αναστέλλει τη βακτηριακή μεταγραφή του DNA σε mRNA αναστέλλοντας την εξαρτώμενη από το DNA RNA πολυμεράση δεσμεύοντας τη βήτα-υπομονάδα της, ενώ η 8-υδροξυκινολίνη είναι ένας αντιμυκητιακός αναστολέας μεταγραφής.[55] Τα αποτελέσματα της μεθυλίωσης της ιστόνης μπορεί επίσης να λειτουργήσουν για να αναστέλλουν τη δράση της μεταγραφής. Ισχυρά, βιοδραστικά φυσικά προϊόντα όπως η τριπτολίδη που αναστέλλουν τη μεταγραφή σε θηλαστικά μέσω της αναστολής της υπομονάδας XPB του γενικού μεταγραφικού παράγοντα TFIIH έχει πρόσφατα αναφερθεί ως συζυγές γλυκόζης για τη στόχευση υποξικών καρκινικών κυττάρων με αυξημένη παραγωγή μεταφορέα γλυκόζης.[56]
Remove ads
Ενδογενείς αναστολείς
Στα σπονδυλωτά, η πλειοψηφία των γονιδίων προαγωγέων περιέχει μια νησίδα CpG με πολυάριθμες θέσεις CpG.[57] Όταν πολλές από τις θέσεις CpG προαγωγέα ενός γονιδίου μεθυλιώνονται το γονίδιο αναστέλλεται (αποσιωπάται).[58] Οι καρκίνοι του παχέος εντέρου έχουν τυπικά 3 έως 6 οδηγούς μεταλλάξεων και 33 έως 66 μεταλλάξεις ωτοστόπ (hitchhiker) ή επιβατών.[59] Ωστόσο, η μεταγραφική αναστολή (σίγαση) μπορεί να έχει μεγαλύτερη σημασία από τη μετάλλαξη στην πρόκληση εξέλιξης σε καρκίνο. Για παράδειγμα, σε καρκίνους του παχέος εντέρου περίπου 600 έως 800 γονίδια αναστέλλονται μεταγραφικά από τη μεθυλίωση της νησίδας CpG. Η μεταγραφική καταστολή στον καρκίνο μπορεί επίσης να συμβεί από άλλους επιγενετικούς μηχανισμούς, όπως η αλλοιωμένη παραγωγή των μικροRNAs.[60] Στον καρκίνο του μαστού, η μεταγραφική καταστολή του BRCA1 μπορεί να συμβεί πιο συχνά από υπερπαραγωγή μικροRNA-182 παρά από υπερμεθυλίωση του προαγωγέα BRCA1.
Remove ads
Εργοστάσια μεταγραφής
Οι ενεργές μονάδες μεταγραφής συγκεντρώνονται στον πυρήνα, σε διακριτές τοποθεσίες που ονομάζονται εργοστάσια μεταγραφής (Transcription factories) ή ευχρωματίνη (euchromatin). Τέτοιες θέσεις μπορούν να οπτικοποιηθούν επιτρέποντας στις δεσμευμένες πολυμεράσες να επεκτείνουν τα μεταγραφήματά τους σε επισημασμένους προδρόμους (Br-UTP ή Br-U) και ανοσοεπισήμανση του επισημασμένου εκκολαπτόμενου RNA. Τα εργοστάσια μεταγραφής μπορούν επίσης να εντοπιστούν χρησιμοποιώντας υβριδισμό φθορισμού in situ ή να επισημανθούν από αντισώματα που κατευθύνονται κατά των πολυμερασών. Υπάρχουν ≈10.000 εργοστάσια στο νουκλεόπλασμα ενός κυττάρου HeLa, μεταξύ των οποίων είναι ≈8.000 εργοστάσια πολυμεράσης II και ≈2.000 εργοστάσια πολυμεράσης III. Κάθε εργοστάσιο πολυμεράσης II περιέχει ≈8 πολυμεράσες. Καθώς οι περισσότερες ενεργές μονάδες μεταγραφής συνδέονται με μία μόνο πολυμεράση, κάθε εργοστάσιο περιέχει συνήθως ≈8 διαφορετικές μεταγραφικές μονάδες. Αυτές οι μονάδες μπορεί να συσχετίζονται μέσω προαγωγέων και/ή ενισχυτών, με βρόχους που σχηματίζουν ένα σύννεφο γύρω από τον παράγοντα.[61]
Remove ads
Ιστορικό
Ένα μόριο που επιτρέπει στο γενετικό υλικό να πραγματοποιηθεί ως πρωτεΐνη υποτέθηκε για πρώτη φορά από τους Φρανσουά Ζακόμπ και Ζακ Μονό. Ο Severo Ochoa κέρδισε Βραβείο Νόμπελ Φυσιολογίας και Ιατρικής το 1959 για την ανάπτυξη μιας διαδικασίας σύνθεσης RNA in vitro με πολυνουκλεοτιδική φωσφορυλάση, η οποία ήταν χρήσιμη για τη διάσπαση του γενετικού κώδικα. Η σύνθεση RNA από RNA πολυμεράση καθιερώθηκε "in vitro" από πολλά εργαστήρια μέχρι το 1965. Ωστόσο, το RNA που συντίθεται από αυτά τα ένζυμα είχε ιδιότητες που υποδηλώνουν την ύπαρξη ενός πρόσθετου παράγοντα που απαιτείται για να τερματιστεί σωστά η μεταγραφή. Ο Roger D. Kornberg κέρδισε το 2006 Βραβείο Νόμπελ Χημείας "για τις μελέτες του σχετικά με τη μοριακή βάση της ευκαρυωτικής μεταγραφής".[62]
Remove ads
Μέτρηση και ανίχνευση

Η μεταγραφή μπορεί να μετρηθεί και να ανιχνευθεί με διάφορους τρόπους
- Προσδιορισμός μεταγραφής με κασέτα χωρίς γουανίνη (G-Less Cassette): μετρά την ισχύ του προαγωγέα (υποκινητή)
- Προσδιορισμός μεταγραφής Run-off: προσδιορίζει τοποθεσίες έναρξης μεταγραφής (transcription start sites, TSS)
- Προσδιορισμός Nuclear run-on: μετρά τη σχετική αφθονία των νεοσχηματισμένων μεταγραφημάτων
- KAS-seq: μετρά μονόκλωνο DNA που παράγεται από RNA πολυμεράσες. Μπορεί να λειτουργήσει με 1.000 κύτταρα.[63]
- Δοκιμασία προστασίας ριβονουκλεάσης (RNase protection assay) and ChIP-Chip της RNA πολυμεράσης: εντοπισμός ενεργών θέσεων μεταγραφής
- RT-PCR: μετρά την απόλυτη αφθονία των επιπέδων ολικού ή πυρηνικού RNA, τα οποία ωστόσο μπορεί να διαφέρουν από τους ρυθμούς μεταγραφής
- Μικροσυστοιχίες DNA: μετρούν τη σχετική αφθονία των γενικών επιπέδων ολικού ή πυρηνικού RNA• Ωστόσο, αυτά μπορεί να διαφέρουν από τα ποσοστά μεταγραφής
- Φθορίζων επιτόπιος υβριδισμός (In situ hybridization): ανιχνεύει την παρουσία μεταγραφήματος
- Επισήμανση MS2: με την ενσωμάτωση βρόχων κορμών (stem loops) του RNA, όπως το MS2, σε ένα γονίδιο, αυτά ενσωματώνονται στο νεοσυντιθέμενο RNA. Οι βρόχοι κορμού μπορούν στη συνέχεια να ανιχνευθούν χρησιμοποιώντας μια σύντηξη του GFP και της πρωτεΐνης περιβλήματος MS2, η οποία έχει υψηλή συγγένεια, ειδική για την αλληλουχία αλληλεπίδραση με τους βρόχους στελέχους MS2. Η στρατολόγηση του GFP στη θέση της μεταγραφής οπτικοποιείται ως ένα μόνο φθορίζον σημείο. Αυτή η νέα προσέγγιση έχει αποκαλύψει ότι η μεταγραφή λαμβάνει χώρα σε ασυνεχείς εκρήξεις ή παλμούς. Με την αξιοσημείωτη εξαίρεση των επιτόπιων τεχνικών, οι περισσότερες άλλες μέθοδοι παρέχουν μέσους όρους κυτταρικού πληθυσμού και δεν είναι ικανές να ανιχνεύσουν αυτή τη θεμελιώδη ιδιότητα των γονιδίων.[64]
- Στύπωμα Northern (Northern blot) η παραδοσιακή μέθοδος, και μέχρι την εμφάνιση του RNA-Seq, η πιο ποσοτική
- Αλληλούχιση RNA (RNA-Seq): εφαρμόζει τεχνικές αλληλούχισης επόμενης γενιάς για την αλληλουχία ολόκληρων μεταγραφωμάτων (transscriptomes), που επιτρέπει τη μέτρηση της σχετικής αφθονίας του RNA, καθώς και την ανίχνευση πρόσθετων παραλλαγών όπως γονίδια σύντηξης, μετα-μεταγραφικές επεξεργασίες και νέες τοποθεσίες ματίσματος
- Αλληλούχιση μεμονωμένου κυττάρου (Single-cell RNA-sequencing): ενισχύει και διαβάζει μερικά μεταγραφώματα από απομονωμένα κύτταρα, επιτρέποντας λεπτομερείς αναλύσεις του RNA σε ιστούς, έμβρυα και καρκίνους
Remove ads
Αντίστροφη μεταγραφή

Ορισμένοι ιοί (όπως ο HIV, η αιτία του AIDS), έχουν την ικανότητα να μεταγράφουν το RNA σε DNA. Ο HIV έχει ένα γονιδίωμα RNA που είναι "αντίστροφα μεταγραμμένο" σε DNA. Το DNA που προκύπτει μπορεί να συγχωνευθεί με το γονιδίωμα του DNA του κυττάρου ξενιστή. Το κύριο ένζυμο που είναι υπεύθυνο για τη σύνθεση του DNA από ένα πρότυπο RNA ονομάζεται αντίστροφη μεταγραφάση.[65] Στην περίπτωση του HIV, η αντίστροφη μεταγραφάση είναι υπεύθυνη για τη σύνθεση ενός κλώνου συμπληρωματικού DNA (cDNA) στο γονιδίωμα του ιικού RNA. Το ένζυμο ριβονουκλεάση Η στη συνέχεια χωνεύει τον κλώνο RNA και η αντίστροφη μεταγραφάση συνθέτει έναν συμπληρωματικό κλώνο DNA για να σχηματίσει μια δομή DNA διπλής έλικας (cDNA). Το cDNA ενσωματώνεται στο γονιδίωμα του κυττάρου ξενιστή από το ένζυμο ενσωματάση (integrase), το οποίο αναγκάζει το κύτταρο ξενιστή να παράγει ιικές πρωτεΐνες που επανασυναρμολογούνται σε νέα ιικά σωματίδια. Στον HIV, μετά από αυτό, το κύτταρο ξενιστής υφίσταται προγραμματισμένο κυτταρικό θάνατο, ή απόπτωση, των Τ κυττάρων.[66] Ωστόσο, σε άλλους ρετροϊούς, το κύτταρο ξενιστής παραμένει άθικτο καθώς ο ιός βγαίνει από το κύτταρο. Ορισμένα ευκαρυωτικά κύτταρα περιέχουν ένα ένζυμο με αντίστροφη μεταγραφική δραστηριότητα που ονομάζεται τελομεράση (telomerase). Η τελομεράση φέρει ένα πρότυπο RNA από το οποίο συνθέτει ένα τελομερές, μια επαναλαμβανόμενη αλληλουχία DNA, μέχρι το τέλος των γραμμικών χρωμοσωμάτων. Είναι σημαντικό γιατί κάθε φορά που ένα γραμμικό χρωμόσωμα διπλασιάζεται, μικραίνει. Με το τελομερές στα άκρα των χρωμοσωμάτων, η βράχυνση εξαλείφει μέρος της μη βασικής, επαναλαμβανόμενης αλληλουχίας, αντί της αλληλουχίας DNA που κωδικοποιεί την πρωτεΐνη πιο μακριά από το άκρο του χρωμοσώματος. Η τελομεράση ενεργοποιείται συχνά σε καρκινικά κύτταρα για να επιτρέψει στα καρκινικά κύτταρα να αντιγράψουν τα γονιδιώματά τους επ' αόριστον χωρίς να χάσουν σημαντική αλληλουχία DNA που κωδικοποιεί πρωτεΐνες. Η ενεργοποίηση της τελομεράσης θα μπορούσε να είναι μέρος της διαδικασίας που επιτρέπει στα καρκινικά κύτταρα να γίνουν αθάνατα. Ο παράγοντας αθανασίας του καρκίνου μέσω της επιμήκυνσης των τελομερών λόγω της τελομεράσης έχει αποδειχθεί ότι εμφανίζεται στο 90% όλων των καρκινογόνων όγκων in vivo με το υπόλοιπο 10% να χρησιμοποιεί μια εναλλακτική οδό συντήρησης τελομερών που ονομάζεται ALT ή εναλλακτική επιμήκυνση των τελομερών (Alternative Lengthening of Telomeres, ALT).[67]
Remove ads
Σημειώσεις
Παραπομπές
Εξωτερικοί σύνδεσμοι
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

