χημική ένωση From Wikipedia, the free encyclopedia
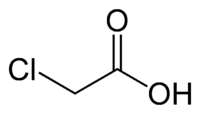
Το χλωροξικό οξύ ή χλωροξικό οξύ [αγγλικά (Mono)ChloroAcetic acid] είναι οργανική χημική ένωση, με μοριακό τύπο C2H3ClO2, αν και συνηθέστερα παριστάνεται με τον ημισυντακτικό τύπο ClCH2CO2H. Είναι το απλούστερο χλωρoκαρβοξυλικό οξύ, το οποίο είναι μια χρήσιμη συνθετική πρόδρομη ύλη για την οργανική σύνθεση. Το χημικά καθαρό χλωροξικό οξύ, στις κανονικές συνθήκες περιβάλλοντος, είναι άχρωμο στερεό. Συγγενικές ενώσεις του είναι το φθοροξικό οξύ (FCH2CO2H), το βρωμοξικό οξύ (BrCH2CO2H), το ιωδοξικό οξύ (ICH2CO2H), το διχλωροξικό οξύ (Cl2CHCO2H) και το τριχλωροξικό οξύ (Cl3CCO2H).
| Χλωροξικό οξύ | |
|---|---|
 | |
 | |
| Γενικά | |
| Όνομα IUPAC | Χλωραιθανικό οξύ |
| Άλλες ονομασίες | Χλωροξικό οξύ |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C2H3ClO2 |
| Μοριακή μάζα | 94,50 amu |
| Σύντομος συντακτικός τύπος | ClCH2COOH |
| Συντομογραφίες | MCA |
| Αριθμός CAS | 79-11-8 |
| SMILES | ClCC(O)=O |
| InChI | 1S/C2H3ClO2/c3-1-2(4)5/h1H2,(H,4,5) |
| Αριθμός EINECS | 201-178-4 |
| Αριθμός RTECS | AF8575000 |
| Αριθμός UN | 5GD84Y125G |
| PubChem CID | 300 |
| ChemSpider ID | 10772140 |
| Δομή | |
| Φυσικές ιδιότητες | |
| Σημείο τήξης | 63 °C |
| Σημείο βρασμού | 189,3 °C |
| Πυκνότητα | 1.580 kg/m³ |
| Διαλυτότητα στο νερό | 858 kg/m³ |
| Δείκτης διάθλασης , nD | 1,4351 (55 °C) |
| Χημικές ιδιότητες | |
| pKa | 2,86 |
| Ελάχιστη θερμοκρασία ανάφλεξης | 126 °C |
| Σημείο αυτανάφλεξης | <500 °C |
| Ιδιότητες εκρηκτικού | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Το χλωροξικό οξύ πρωτοπαράχθηκε (αν και σε χημικά μη καθαρή μορφή) το έτος 1843, από το γάλλο χημικό Φέλιξ ΛεΜπλάνκ (Félix LeBlanc, 1813-1886).[1] Η παραγωγή αυτή έγινε με φωτοχημική (χρησιμοποιώντας ηλιακό φως) χλωρίωση οξικού οξέος (CH3CO2H). Λίγο αργότερα, το 1857, παράχθηκε σε χημικά καθαρή μορφή από το γερμανό χημικό Ρέινχολντ Χόφφμανν (Reinhold Hoffmann, 1831-1919), με την ίδια μέθοδο, δηλαδή με φωτοχημική χλωρίωση «παγόμορφου», δηλαδή χημικά καθαρού (αυτήν τη φορά) οξικού οξέος.[2] Τέλος, επίσης το 1857, ο γάλλος χημικός Τσαρλς Αντόλφ Βουρτζ (Charles Adolphe Wurtz), παρασκεύασε χλωροξικό οξύ με υδρόλυση χλωρακετυλοχλωριδίου (ClCH2COCl).[3]
Η παγκόσμια ετήσια βιομηχανική παραγωγή του χλωραιθανικού οξέος το 2010 ήταν 706.000 τόνοι[4], πάνω από το ήμισυ της οποίας παράγονταν από την Κίνα. Άλλες χώρες με σημαντική ετήσια παραγωγική χωρητικότητα σε χλωροξικό οξύ είναι η Γερμανία (105.000 τόνοι, η Ολλανδία (100.000 τόνοι), η Ινδία (>65.000 τόνοι) και οι ΗΠΑ (55.000 τόνοι).
Το 2017, η ετήσια παγκόσμια παραγωγή χλωροξικού οξέος ανέρχονταν σε περίπου 420.000 τόνους.[5]
Το χλωροξικό οξύ παράγεται βιομηχανικά μέσω δύο (2) κύριων παραγωγικών οδών:
Η κυριότερη από αυτές περιλαμβάνει τη χλωρίωση οξικού οξέος, χρησιμοποιώντας οξικό ανυδρίτη [(CH3CO)2O] ως καταλύτη:
Η άλλη κύρια βιομηχανική οδός περιλαμβάνει την υδρόλυση τριχλωραιθενίου (CCl2=CHCl), χρησιμοποιώντας θειικό οξύ (H2SO4) ως καταλύτη:
Η παραπάνω αναφερόμενη συνολική στοιχειομετρική εξίσωση αναλύεται ως ακολούθως: Αρχικά γίνεται αντίδρση προσθήκης ύδατος στο τριχλωραιθυλένιο. Αποτέλεσμα της αντίδρασης αυτής είναι η ενδιάμεση παραγωγή 1,1,2-τριχλωραιθανόλης (ClCH2CCl2OH):
Η ένωση αυτή (1,1,2-τριχλωραιθανόλη) είναι ασταθής και αυταφυδροχλωριώνεται, παράγοντας χλωρακετυλοχλωρίδιο:
To χλωρακετυλοχλωρίδιο στη συνέχεια υδρολύεται σε χλωροξικό οξύ, δηλαδή παρόμοια με τη μέθοδο που πρωτοχρησιμοποίησε ο Βουρτζ (δείτε παραπάνω, στην «Ιστορία»):
Προσθέτοντας κατά μέλη τις τρεις (3) παραπάνω μερικές στοιχειομετρικές εξισώσεις παράγεται η παραπάνω αναφερόμενη συνολική στοιχειομετρική εξίσωση.
Η μέθοδος αυτή της υδρόλυσης χρησιμοποιείται όταν απαιτείται χημικά καθαρό χλωροξικό οξύ, γιατί με τη μέθοδο της χλωρίωσης οξικού οξέος συμπαράγονται διχλωραιθοξικό οξύ και τριχλωροξικό οξύ, που είναι (σχετικά) δύσκολο (και άρα ασύμφορο) να διαχωριστούν από το χλωροξικό οξύ με απόσταξη. Ωστόσο, οι σημαντικές επιπλέον ποσότητες υδροχλωρίου που συμπαράγονται και απελευθερώνονται, με αρνητική επίπτωση στο περιβάλλον, είτε ανάγκη εξουδετέρωσης, έχει οδηγήσει σε αυξανόμενη δημοτικότητα την παραγωγική οδό της αλογόνωσης οξικού οξέος.[5]
Μια αντίδραση που υπογραμμίζει τη χρησιμότητα του χλωροξικού οξέος ως πρόδρομης ένωσης για την οργανική χημεία είναι η O-αλκυλίωση σαλικυλαλδεΰδης από χλωροξικό οξύ, ακολουθούμενης από αποκαρβοξυλίωση του ενδιάμεσα σχηματιζόμενου αιθέρα, παράγοντας (τελικά) βενζοφουράνιο:[6]
Στη βιομηχανία, το χλωροξικό οξύ χρησιμοποιήθηκε ως πρόδρομη ύλη για την παραγωγή μιας ποικιλίας χρήσιμων προϊόντων που συμπεριλαμβάνουν φάρμακα, βερνίκια και φυτοφάρμακα.[5] Οι περισσότερες εφαρμογές αξιοποιούν την υψηλή δραστικότητα του χημικού δεσμού C-Cl που η ένωση διαθέτει.[7] Πιο συγκεκριμένα, το χλωροξικό οξύ αποτελεί πρόδρομη ένωση για τα ζιζανιοκτόνα γλυφοσάτιο, MCPA (2-Μethyl-4-ChloroPhenoxyAcetic acid, 2-μεθυλο-4-χλωροφαινυλοξικό οξύ) και διμεθοάτιο, αφού όλα αυτά παράγονται με αλκυλίωση χλωροξικού οξέος. Ακόμη, το χλωροξικό οξύ μπορεί να μετατραπεί σε χλωρακετυλοχλωρίδιο, που αποτελεί, με τη σειρά του, πρόδρομη ένωση για την αδρεναλίνη (ή επινεφρίνη). Η υποκατάσταση του καρβονυλικού χλωρίου στο χλωρακετυλοχλωρίδιο από σουλφίδιο δίνει θειογλυκολικό οξύ, που με τη σειρά του χρησιμοποιείται ως σταθεροποιητής για το πολυβινυλοχλωρίδιο (PVC) και ως συστατικό σε κάποια καλλυντικά.
Μια άλλη μεγάλη κλίμακας εφαρμογή του χλωροξικό οξύ είναι η χρήση του ως πρόδρομη ένωση για πυκνωτικό μέσο για την καρβοξυμεθυλοκυτταρίνη και το καρβοξυμεθυλάμυλο.
Όπως και τα άλλα χλωραιθανικά οξέα (δηλαδή το διχλωροξικό οξύ και τριχλωροξικό οξύ), αλλά και οι συγγενικοί αλ(υδρογον)άνθρακες, το χλωροξικό οξύ είναι επικίνδυνο αλκυλιωτικό μέσο. Το LD50 της ένωσης για τους αρουραίους ανέρχεται σε 76 kg/m³.[5]
Το χλωροξικό οξύ εύκολα διαπερνά το δέρμα και τους βλεννογόνους, πέρνοντας μέρος στο κυτταρικό σύστημα παραγωγικής ενέργειας. Η έκθεση του δέρματος σε υψηλής συγκέντρωσης (περί το 80%) διαλύματος σε χλωροξικό οξύ, αρχικά φαίνεται ότι δεν προκαλεί μεγάλη βλάβη, αλλά η συστημική δηλητηρίαση που προκαλεί μπορεί να είναι παρούσα σε (μερικές) ώρες. Η έκθεση σε χλωροξικό οξύ μπορεί να είναι θανατηφόρα, αν πάνω από το 6% της επιφάνειας του σώματος εκτεθεί στην επίδραση αυτής της ένωσης. Το χλωροξικό νάτριο (ClCH2CO2Na) δεν διαπερνά το δέρμα όπως το οξύ, αλλά μπορεί να προκαλέσει παρόμοιες βλάβες αν ο χρόνος έκθεσης ή και η επιφάνεια έκθεσης είναι (αρκετά) μεγαλύτερες.
Σε περίπτωση έκθεσης θύματος σε χλωροξικό οξύ, απαιτείται άμεσος καθαρισμός της περιοχής του σώματος που εκτέθηκε σε αυτήν τη χημική ένωση με νερό ή καλύτερα με όξινο ανθρακικό (HCO3-) διάλυμα, ώστε τουλάχιστον να εξουδετερωθεί ως οξύ και να αποφευχθεί έτσι η επιπλέον απορρόφησή του από το δέρμα.
Το αντίδοτο στη δηλητηρίαση από χλωροξικό οξύ είναι το διάλυμα διχλωραιθανικού νατρίου (CHCl2CO2Na, 50 mg/kg, με έκπλυση για πάνω από 10 λεπτά της ώρας και επανάληψη μετά από 2 ώρες. Απαιτείται διπλή δόση αν έχει συμβεί αιμοδιάλυση του χλωραιθανικού οξέος).[8][9][10]
Το χλωροξικό οξύ έχει ταξινομηθεί στις εξαιρετικά βλαβερές ουσίες από τις ΗΠΑ, όπως ορίστηκε στο Κεφάλαιο 302 του Emergency Planning and Community Right-to-Know Act των ΗΠΑ (42 U.S.C. 11002) και οι εγκαταστάσεις που το παράγουν, αποθηκεύουν ή το χρησιμοποιούν σε σημαντικές ποσότητες απαιτείται αυστηρώς να πληρούν σαφείς προδιαγραφές ασφαλείας.[11]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.