Strahlennekrose
Aus Wikipedia, der freien Enzyklopädie
Als Strahlennekrose, auch Radionekrose genannt, bezeichnet man das durch die Einwirkung ionisierender Strahlung ausgelöste Absterben von Zellen eines Organismus. Radionekrosen sind die wichtigste und schwerwiegendste Komplikation radiochirurgischer Behandlungen, die meist erst Monate oder Jahre nach der Bestrahlung klinisch auffällig wird.[1]
| Klassifikation nach ICD-10 | |
|---|---|
| T66 | Nicht näher bezeichnete Schäden durch Strahlung Radionekrose anderweitig nicht klassifiziert |
| ICD-10 online (WHO-Version 2019) | |
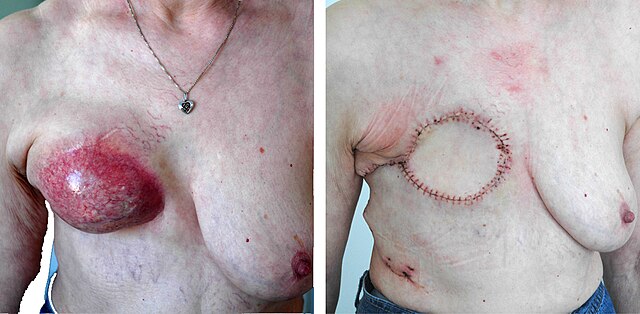
(B) Dieselbe Patientin nach der operativen Entfernung der Radionekrose

Eine Sonderform ist die Osteoradionekrose. Diese Form der Knochennekrose kann ebenfalls nach einer Strahlentherapie auftreten und wird in einem gesonderten Artikel behandelt.
Beschreibung und klinisches Bild
Zusammenfassung
Kontext
Strahlennekrosen können im gesunden Gewebe nach einer lokalen Einwirkung ionisierender Strahlung entstehen. In den weitaus meisten Fällen erfolgt die Bestrahlung gezielt und dosiskontrolliert, beispielsweise im Rahmen einer Strahlentherapie. In der Radioonkologie ist die Strahlennekrose des Tumors beziehungsweise seiner Metastasen, die Tumornekrose, das primäre Ziel der Bestrahlung. Deshalb ist nicht jede Strahlennekrose eine Komplikation.[1][2] Der Begriff Strahlennekrose wird in der allgemeinen Fachsprache aber nur für strahleninduzierte Nekrosen im gesunden Gewebe verwendet.
Strahlennekrosen treten als iatrogene Gewebeschädigung speziell nach der Strahlentherapie zerebraler Tumoren (Hirntumoren) auf. Die durchschnittliche Latenzzeit beträgt hier 14 Monate nach der Bestrahlung.[3] Darüber hinaus sind Fälle bekannt, bei denen über 25 Jahre[4] zwischen der Strahlentherapie und den Symptomen der sich daraus entwickelnden Strahlennekrose vergingen.[5]
Die raumfordernde umschriebene Strahlennekrose der weißen Substanz (Substantia alba) führt zu fokal-neurologischen Defiziten, epileptischen Anfällen und pathologisch erhöhtem Hirndruck.[3] Die Strahlennekrosen erzeugen ein Perifokalödem.[1] Makrophagen, die prinzipiell in der Lage sind Nekrosen abzubauen, können nicht einwandern. Die am Ort der Nekrose vorhandenen Mikrogliazellen, die ebenfalls in der Lage sind Zellreste abgestorbener Zellen zu phagozytieren, wurden durch die Bestrahlung abgetötet. Hydrolytische Enzyme wurden durch die Bestrahlung deaktiviert. Sie weisen einen vergleichsweise großen „Wirkungsquerschnitt“ auf. In dem nekrotischen Areal finden sich teilweise stark aufgeweitete Blutgefäße, die eine Stauungshyperämie bewirken und zu einer Erythrodiapedese (Austritt von Erythrozyten aus Blutgefäßen in das Extravasat) führen können.[6]
Pathologisch gesehen handelt es sich bei der Strahlennekrose um eine Koagulationsnekrose.[7]
Auch nach der Behandlung von arteriovenösen Malformationen (AVM) können Radionekrosen auftreten.[8] Darüber hinaus können Strahlennekrosen auch durch Strahlenunfälle hervorgerufen werden.[9][10]
Die genauen pathologischen Vorgänge, die zu einer Strahlennekrose und speziell zu den teilweise sehr langen Latenzzeiträumen führen, sind noch weitgehend unklar. Molekulare und zelluläre Mechanismen sind für die Entstehung verantwortlich. Zytokine, wie beispielsweise der Tumornekrosefaktor, und inflammatorische Genprodukte spielen dabei eine wesentliche Rolle.[11][12]
Inzidenz
Zusammenfassung
Kontext
Die genaue Häufigkeit von Strahlennekrosen ist nicht bekannt, da – speziell bei zerebralen Tumoren – ein Großteil der Patienten an der Krebserkrankung verstirbt, bevor sich eine Strahlennekrose ausbilden kann. Bei zerebralen Tumoren geht man von einer Häufigkeit von etwa 5 % aus, wenn die Patienten eine Dosis von 45 Gray und mehr erhalten haben.[3]
Das Risiko einer Strahlennekrose steigt mit der Dosis und der Größe des bestrahlten Gewebevolumens,[13] kann aber durch eine Fraktionierung, das ist das Verteilen der Gesamtstrahlungsdosis über mehrere Sitzungen, reduziert werden.[14] Über eine Formel kann das Risiko einer Radionekrose abgeschätzt werden.[13][15] Mit den erheblichen Fortschritten bei der Weiterentwicklung der Strahlentherapie ist die Inzidenz im Vergleich zu den Anfängen der Radiotherapie erheblich gesunken. Die modernen Bestrahlungstechniken schonen das gesunde Gewebe so gut wie möglich. Grundsätzlich besteht jedoch das Dilemma zwischen dem Schonen des gesunden Gewebes, zur Vermeidung einer Strahlennekrose, und einer möglichst großflächigen Bestrahlung des Gebietes um den Tumor, um ein Rezidiv zu vermeiden.
Bei zerebralen Tumoren oder Knochenmetastasen wird, aufgrund der meist sehr schlechten Prognose, das Risiko einer Radionekrose bewusst eingegangen.[3] Die genannten Läsionen sind zudem meist inoperabel (nicht zu operieren), so dass die Strahlentherapie die Ultima Ratio darstellt.[1] Bei gutartigen Erkrankungen, wie beispielsweise arteriovenösen Malformationen, ist das Nutzen-Risiko-Verhältnis deutlich ungünstiger.[3]
Diagnose
Zusammenfassung
Kontext
In der klinischen Praxis ist die Unterscheidung zwischen Tumorrezidiv, also dem erneuten Auftreten der Tumorerkrankung (meist durch unvollständige Entfernung des Tumors verursacht), und einer Strahlennekrose schwierig. Beide Erkrankungen treten am selben zu erwartenden Ort, das heißt in dem Bereich des zuvor entfernten Tumors und seiner unmittelbaren Umgebung, auf. Rezidiv und Strahlennekrose zeichnen sich beide durch Raumforderungen aus und die Latenzzeiten nach Tumorentfernung und Bestrahlung sind sich sehr ähnlich.[8]
Verschiedene bildgebende Verfahren können zur Differentialdiagnose eingesetzt werden. Mit der Magnetresonanzspektroskopie (MRS) können die im Gebiet der Strahlennekrose reduzierten Konzentrationen an N-Acetyl-Aspartat (NAA), Cholin und Kreatin, und der im Tumor(rezidiv) erhöhte Gehalt an Cholin die Unterscheidung ermöglichen.[8]
In der Computertomographie (CT) und in der Magnetresonanztomographie (MRT) erscheint eine Radionekrose meist als ringförmige, von einem Ödem umgebene Struktur, die ein gegebenenfalls appliziertes Kontrastmittel aufnimmt. Mit diesen beiden bildgebenden Verfahren lässt sich eine Radionekrose kaum von einem Rezidiv unterscheiden.[16][17][14]
Die Positronen-Emissions-Tomographie (PET) mit dem Radiotracer 18F-Fluordesoxyglucose (FDG) ist ein häufig verwendetes bildgebendes Verfahren zur Differenzierung zwischen Rezidiv und Strahlennekrose. Tumorzellen zeigen eine erhöhte Aufnahme an FDG (auch gegenüber dem gesunden Gewebe), während nekrotische Zellen kein FDG mehr benötigen. Die PET mit FDG hat allerdings ihre Limitierung in der Auflösung, die im Bereich mehrerer Millimeter liegt. Dadurch lässt sich ein umschriebenes Rezidiv in einem Bereich von relativ erniedrigtem Stoffwechsel (Hypometabolismus) nicht sicher nachweisen. Nur wenn sich das Rezidiv durch einen erhöhten Stoffwechsel (Hypermetabolismus) nachweisen lässt, ist die Differentialdiagnose eindeutig.[18][19] Entsprechend hoch ist daher die Sensitivität (81 bis 86 %) der FDG-PET zur Erkennung eines Tumorrezidivs, während die Spezifität mit 22 bis 40 % vergleichsweise gering ist.[20][21] Einige Formen der Radionekrose, so beispielsweise beim nicht-kleinzelligen Bronchialkarzinom (NSCLC) können im FDG-PET eine erhöhte FDG-Aufnahme zeigen.[22]
Einige Autoren empfehlen bei Gehirntumoren als bildgebendes Verfahren die Einzelphotonen-Emissionscomputertomographie (SPECT) mit 201Th-Thallium(I)-chlorid. Auch hier wird der Radiotracer vom malignen Tumor in stärkerem Maße aufgenommen.[23][8][24]
Die Unterschiede zwischen Th-201-SPECT und FDG-PET sind bezüglich Spezifität und Sensitivität vernachlässigbar klein.[21] Die FDG-PET hat sich in der Neuroonkologie als nichtinvasives Diagnoseverfahren der Wahl zur Differenzierung zwischen Tumorrezidiv und Strahlennekrose etabliert.[20][19] Bei zerebralen Tumoren bieten die beiden Radiotracer 18F-Fluorethyltyrosin und 18F-Fluorcholin gegenüber FDG einige Vorteile.[25] Auch 11C-Cholin scheint im Vergleich zu FDG eine höhere Selektivität und Sensitivität zu bieten.[26] Diese Radiotracer sind in der klinischen Praxis bisher allerdings kaum verbreitet.
Neben dem statistisch wahrscheinlichsten Fall eines Rezidivs sind für die Differentialdiagnose im Wesentlichen noch Metastasen und Abszesse und bei einer Krankengeschichte mit zerebralen Tumoren auch Multiple Sklerose in Betracht zu ziehen. Auch eine Fremdkörperreaktion nach einem operativen Eingriff kann ein ähnliches klinisches Bild wie eine Strahlennekrose bewirken.[8]
Größtmögliche diagnostische Sicherheit bietet eine Biopsie, bei der histologisch relativ leicht zwischen gutartigem nekrotischen und bösartigem Gewebe unterschieden werden kann.
Therapie

(A) Das Operationsgebiet. (B) Anlegen von zwei Thoraxdrainagen nach der chirurgischen Entfernung der Radionekrose. (C) und (D) Rekonstruktion der Thoraxwand mit einem doppellagigen Polypropylennetz. (E) Mobilisierung und Umlagerung eines körpereigenen Hautmuskellappens (autologe Transplantation von M. latissimus dorsi) auf der Thoraxwand. (F) Wundverschluss.[27]
Raumfordernde zerebrale Strahlennekrosen lassen sich mit hochdosierten Corticosteroiden, wie beispielsweise Dexamethason, gut behandeln.[3] Zugängliche und operable Radionekrosen können chirurgisch entfernt werden.[16]
Verlauf und Prognose
Unbehandelt entwickelt sich eine Strahlennekrose progredient und ist irreversibel. Im Fall einer Strahlennekrose im Gehirn kann das nekrotische Wachstum durch seinen Raumbedarf für den Patienten fatal werden. Bei jüngeren Patienten ist die Prognose schlechter als bei älteren.[8]
Weiterführende Literatur
- P. G. Morris, P. H. Gutin u. a.: Seizures and radionecrosis from non-small-cell lung cancer presenting as increased fluorodeoxyglucose uptake on positron emission tomography. In: Journal of Clinical Oncology. Band 29, Nr. 12, April 2011, S. e324–e326, ISSN 1527-7755. doi:10.1200/JCO.2010.33.0837. PMID 21263097.
- E. Maranzano, F. Trippa, F. Loreti: Tumor relapse or radionecrosis after radiosurgery: single-photon emission computed tomography for differential diagnosis. In regard to Blonigen u. a. Irradiated volume as a predictor of brain radionecrosis after linear accelerator stereotactic radiosurgery. (Int J Radiat Oncol Biol Phys 2010;77:996-1001). In: International Journal of Radiation Oncology – Biology – Physics. Band 78, Nr. 4, November 2010, S. 1279, ISSN 1879-355X. doi:10.1016/j.ijrobp.2010.07.026. PMID 20970034.
- O. Belohlávek, G. Simonová u. a.: Brain metastases after stereotactic radiosurgery using the Leksell gamma knife: can FDG PET help to differentiate radionecrosis from tumour progression? In: European journal of nuclear medicine and molecular imaging. Band 30, Nr. 1, Januar 2003, S. 96–100, ISSN 1619-7070. doi:10.1007/s00259-002-1011-2. PMID 12483415.
- L. S. Chin, L. Ma, S. DiBiase: Radiation necrosis following gamma knife surgery: a case-controlled comparison of treatment parameters and long-term clinical follow up. In: Journal of Neurosurgery. Band 94, Nr. 6, Juni 2001, S. 899–904, ISSN 0022-3085. doi:10.3171/jns.2001.94.6.0899. PMID 11409517.
- S. T. Chao, J. H. Suh u. a.: The sensitivity and specificity of FDG PET in distinguishing recurrent brain tumor from radionecrosis in patients treated with stereotactic radiosurgery. In: International Journal of Cancer. Band 96, Nr. 3, Juni 2001, S. 191–197, ISSN 0020-7136. PMID 11410888.
- T. Tashima, T. Morioka u. a.: Delayed cerebral radionecrosis with a high uptake of 11C-methionine on positron emission tomography and 201Tl-chloride on single-photon emission computed tomography. In: Neuroradiology. Band 40, Nr. 7, Juli 1998, S. 435–438, ISSN 0028-3940. PMID 9730342.
Weblinks
Commons: Radionekrose – Sammlung von Bildern, Videos und Audiodateien
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
