Die Picoline oder Methylpyridine bilden in der Chemie eine Stoffgruppe von organischen Verbindungen, die zu den Heterocyclen (genauer: Heteroaromaten) zählt. Sie bestehen aus einem Pyridinring, der mit einer Methylgruppe substituiert ist. Durch deren unterschiedliche Anordnung ergeben sich drei Konstitutionsisomere. Sie sind in ihren Eigenschaften dem Pyridin recht ähnlich und können dieses, wo es nicht auf die genaue molekulare Struktur ankommt, leicht ersetzen, z. B. als Lösungsmittel. Ansonsten dienen sie in vielfältiger Weise als Synthesebausteine für pharmazeutische und agrochemische Produkte und der Farbstoffherstellung.[1]
Vertreter
| Picoline | |||||||||||
| Name | 2-Picolin | 3-Picolin | 4-Picolin | ||||||||
| Andere Namen | α-Picolin, 2-Methylpyridin | β-Picolin, 3-Methylpyridin | γ-Picolin, 4-Methylpyridin | ||||||||
| Strukturformel |  |
 |
|||||||||
| CAS-Nummer | 109-06-8 | 108-99-6 | 108-89-4 | ||||||||
| 1333-41-1 (Isomerengemisch) | |||||||||||
| PubChem | 7975 | 7970 | 7963 | ||||||||
| FL-Nummer | 14.134 | 14.135 | 14.136 | ||||||||
| Summenformel | C6H7N | ||||||||||
| Molare Masse | 93,13 g·mol−1 | ||||||||||
| Aggregatzustand | flüssig | ||||||||||
| Kurzbeschreibung | farblose Flüssigkeit | ||||||||||
| Schmelzpunkt | −70 °C[2] | −18 °C[3] | 3 °C[4] | ||||||||
| Siedepunkt | 128 °C[2] | 144 °C[3] | 145 °C[4] | ||||||||
| pKs-Wert[5] (der konjugierten Säure BH+) |
5,94 | 5,63 | 6,03 | ||||||||
| Löslichkeit | vollständig mit Wasser mischbar | ||||||||||
| GHS- Kennzeichnung |
|
|
| ||||||||
| H- und P-Sätze | 226‐302+332‐311‐314‐335 | 226‐302‐311‐332‐314 | 226‐302+332‐311‐315‐319‐335 | ||||||||
| keine EUH-Sätze | 071 | keine EUH-Sätze | |||||||||
| 210‐280‐301+312 303+361+353‐304+340+310‐305+351+338 |
210‐280‐301+312 303+361+353‐304+340‐305+351+338 |
210‐280‐301+312 303+361+353‐304+340+312‐305+351+338 | |||||||||
Geschichte
Das 2-Picolin wurde erstmals im Jahre 1846 durch T. Anderson aus Steinkohlenteer isoliert.[6] Die Bezeichnung Picoline setzt sich aus lateinisch pix (Pech) und Oleum (Öl) zusammen.[1]
Vorkommen

Natürlich kommen 2-Methylpyridin, 3-Methylpyridinin und 4-Methylpyridinin in Tee vor.[7][8][9] 4-Methylpyridinin wird auch in den Blättern der Feige gefunden.[9]
Darstellung
Derzeit wird 2-Picolin vor allem auf zwei Synthesewegen hergestellt: durch Kondensation von Acetaldehyd, Formaldehyd und Ammoniak[10] sowie durch Cyclisierung von Nitrilen und Acetylen (Bönnemann-Cyclisierung).[11] Ein Beispiel ist die Reaktion von Acetaldehyd und Ammoniak:

Ca. 8000 t wurden weltweit im Jahr 1989 hergestellt.[10]
3-Methylpyridin wird technisch durch Reaktion von Acrolein mit Ammoniak hergestellt:[10]
Ein effizienterer Weg geht aus von Acrolein, Propionaldehyd und Ammoniak:
Ca. 9.000 t wurden weltweit im Jahr 1989 hergestellt.[12]
Eigenschaften
Die Picoline sind farblose Flüssigkeiten mit einem pyridinartigen Geruch. Sie sind mit Wasser, Ethanol und Diethylether mischbar.[1] Das 4-Picolin, das die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt.
Da im 2- und 4-Picolin die Methylgruppen in direkter Konjugation zum elektronenziehenden Stickstoffatom angeordnet sind, lassen sich die Methylgruppen in diesen beiden Isomeren relativ leicht durch starke Basen wie Lithiumdiisopropylamid oder Butyllithium deprotonieren und dann weiter derivatisieren.[13]
Verwendung
Picoline werden als Zwischenprodukte zur Herstellung von anderen chemischen Verbindungen verwendet. So kann aus 2-Picolin das 2-Vinylpyridin und die Agrochemikalie Nitrapyrin hergestellt werden.[10] 3-Picolin dient zum Beispiel als Ausgangsstoff für die Synthese von Chlorpyrifos und Niacin[10], 4-Picolin für die Herstellung des Anti-Tuberkulose-Wirkstoffs Isoniazid.[10]
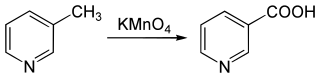
Durch Oxidation, z. B. mittels Kaliumpermanganat (KMnO4)[10][14], entsteht aus 2-Picolin die Picolinsäure, aus 3-Picolin die Nicotinsäure und aus 4-Picolin die Isonicotinsäure.

Siehe auch
Weblinks
Einzelnachweise
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.




