Top-Fragen
Zeitleiste
Chat
Kontext
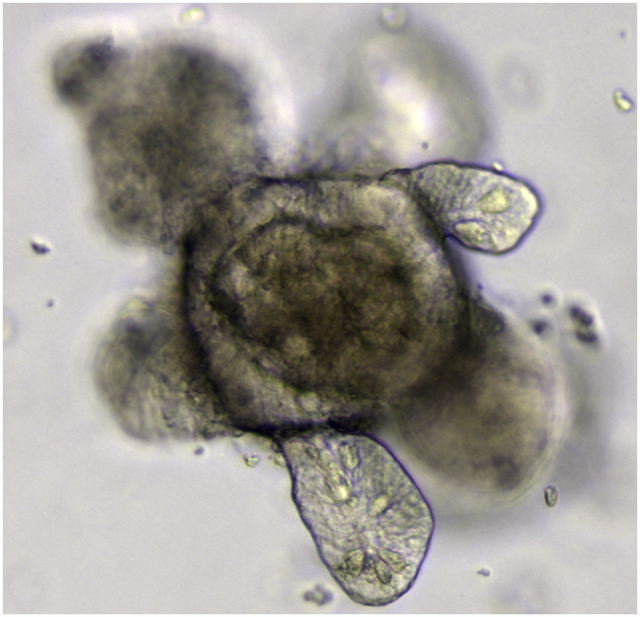
Organoid
verkleinerte und vereinfachte Version eines Organs Aus Wikipedia, der freien Enzyklopädie
Remove ads
Ein Organoid (von griechisch ὄργανον órganon ‚Organ, Werkzeug‘, und εἶδος eidos ‚Art, Form, Gestalt‘) ist eine wenige Millimeter große, organähnliche Mikrostruktur, die mit Methoden der Zellkultur artifiziell erzeugt werden kann. Unter geeigneten Kulturbedingungen können Organoide aus einer oder wenigen Gewebezellen, embryonalen Stammzellen oder induzierten pluripotenten Stammzellen gezüchtet werden. Sofern keine mesenchymalen Stammzellen verwendet wurden,[1] besitzen Organoide kein Stroma und keinerlei Gefäße; sie zeigen dennoch physiologisch relevante, organähnliche Eigenschaften.
Remove ads
Voraussetzungen
Zusammenfassung
Kontext
Zur Erzeugung von Organoiden bedarf es als Ausgangsmaterial pluripotenter Stammzellen. Solche Zellen befinden sich in einem Zustand, aus dem heraus sie fähig sind, sich zu differenzieren und sich gemeinsam zu strukturieren. Ergebnis der Selbstorganisation sind gewebeartige Verbände aus ausdifferenzierten Zellen, die sich in Gestalt und Funktion unterscheiden. Die Struktur von Organoiden gleicht zumindest teilweise menschlichen oder tierischen Organen.
Organoide entstehen meist nicht auf einer Agarschicht; sie brauchen flüssiges Nährmedium, das die Möglichkeit bietet, räumlich in einer 3D-Zellkultur zu wachsen. Die Herstellung von Organoiden erfordert ein steriles Zellkulturlabor, um die anspruchsvolle, konstruktive Gewebezüchtung durchzuführen. In diesem Arbeits- und Forschungsfeld der Biotechnologie werden eventuell auch gentechnische Verfahren eingesetzt, vornehmlich die CRISPR/Cas-Methode.
Die Produktpalette umfasst winzige Modelle innerer Organe (Herz, Magen, Darm, Niere). Erstaunliche Fortschritte gelangen bei den komplexen Strukturen des Gehirns. Solche zerebrale Organoide modellieren Großhirnrinde, Hippocampus, Mittelhirn, Hypothalamus, Kleinhirn, vordere Hypophyse und Augennetzhaut des Menschen, von Säugern, seltener von anderen Wirbeltieren.[2] Für ihre Anzucht gibt es Protokolle, welche die Entwicklung von Regionen des Gehirns bewirken.[3] Forschern gelang es zudem, aus Fruchtwasserzellen fötale Organoide herzustellen.[4]
Remove ads
Zerebrale Organoide
Großhirn-Modelle
Für komplexe Strukturen ist es erforderlich, Teilergebnisse zusammenzuführen. Aus dorsalen und ventralen Organoiden des Großhirns entstand ein Verbund mit dorsoventraler Achse. Fluoreszierende Reportermoleküle stellten Interneurone dar, die von der ventralen zur dorsalen Großhirn-Einheit wanderten.[5]
Kleinhirn-Modelle
Der Kultur menschlicher embryonaler Stammzellen wurden nach und nach Wachstumsfaktoren angeboten. In Selbstorganisation entstanden Zellverbände, die dem embryonalen Neuralrohr glichen. Sie besaßen dorsoventrale Polarität und Vorne-hinten-Ausrichtung. Die Schichtstrukturen wiederholten die Entstehung des Kleinhirns. Und die induzierten Purkinjezellen zeigten spezifisch menschliche Merkmale.[6]
Remove ads
Weitere Organoide
Zusammenfassung
Kontext
Herz-Modelle
Zweidimensionale Kolonien induzierter pluripotenter Stammzellen des Menschen (hiPSC) wurden in dreidimensionale Kulturen überführt. So entstanden, wiederum in Selbstorganisation, winzige Herzkammern. Video eines schlagenden Herzkammer-Organoids zeigt der folgende Link.[7]
Magen-Modelle
Menschliche Magen-Organoide wurden in vitro schrittweise hergestellt, indem man die räumlichen und zeitlichen Zellsignale der natürlichen Magenentwicklung nachahmte. Als Vorbilder dienten Studien an Darm- und Lungen-Geweben. Die Magen-Modelle eignen sich, das Zusammenwirken von Zellen zu studieren, die nicht einem Epithel-Typ angehören, sondern endothelial, neuronal oder mesenchymal sind. Zweck derartiger Studien sei genetischer Modellbau, das Prüfen von Arzneimitteln und künftig die Transplantation.[8]
Darm-Modelle
Das Darmepithel (die oberste Zellschicht des Darms, die die Grenzschicht und Barriere zum Darmlumen mit der Mikrobiota bildet) erneuert sich zeitlebens, ausgehend von sich aktiv teilenden Stammzellen. Diese befinden sich auf dem Grund der Krypten (Einstülpungen der Epithelschicht, die im Dünndarm durch Ausstülpungen (Villi) ergänzt werden). Diese Stammzellen (Lgr5-positive Zellen) erneuern das komplette Darmepithel in ca. 3–5 Tagen unter physiologischen Bedingungen[9]. Aufgrund dieser Besonderheit waren intestinale Organoide, die durch die Kultivierung von Krypten gewonnen wurden, unter den ersten Organoid-Modellen[10]. Außerdem können Darmorganoide auch durch Differenzierung von pluripotenten Stammzellen mit spezifischen Wachstumsfaktoren generiert werden.[11] Darmorganoide eignen sich zur Erforschung von Nährstoff- und Medikamententransportprozessen[12] sowie zur Untersuchung der Hormonausschüttung von Enteroendokrinen Zellen[13]. Außerdem können Darmorganoide auch für infektionsbiologische Studien mit verschiedenen Enterobakterien und Parasiten verwendet werden.[14][15][16][17] Um Organoidmodelle dem Darm eines Menschen oder Tiers noch ähnlicher zu machen, können Darmorganoide auch zusammen mit Immunzellen kultiviert werden.[18]
Die Pionierarbeiten zu Darm-Organoiden stammen von Hans Clevers und Toshiro Sato (2009)[19] und von Akifumi Ootani und Calvin Kuo (2009).[20][21]
Nieren-Modelle
Nach einem Nephron-Protokoll ließen sich Vorläuferzellen für Untereinheiten der menschlichen Niere ausdifferenzieren. Mit geeigneten Biomarkern wies man Podozyten, proximale Nierenkanälchen, Henle-Schleifen und distale Kanälchen nach. Die Strukturfolge war einem Nephron in vivo gleichwertig.[22] Ein Übersichtsartikel berichtet vom Funktionsnachweis an proximalen Nierenkanälchen, die Dextran durch Endozytose aufnahmen. Angeborene Nierenkrankheiten wären mit solchen Organoiden zu simulieren, in deren humane pluripotente Stammzellen krankmachende Mutationen mittels CRISPR eingeschleust wurden. Auf diese Weise sei (unbekannten) Genen auf die Spur zu kommen, die Nierenkrankheiten verursachen.[23]
Remove ads
Forschungsziele
- Prüfung von Arzneimitteln, wodurch die Anzahl von Tierversuchen reduziert werden kann.
- Die Genkaskaden für Differenzierung und Selbstorganisation darstellen.
- Genmutationen ermitteln, die Gestaltfehler der Organe oder deren Funktionsstörungen verantworten.
- Organspenden und Zellspenden entwickeln, die durch Induktion von Stammzellen aus dem Körper des Patienten gewonnen werden. Solche Stammzelltherapien ersetzen passgenau kranke Zellen durch gesunde; sie sind eine Hoffnung der personalisierten Medizin.
Remove ads
Literatur
- Hannes Arthur Wolff: Gehirnorganoide - Grundlegende Rechtsfragen im Spiegel von Naturwissenschaft, Medizin und Ethik, Nomos, Schriften zum Bio-, Gesundheits- und Medizinrecht, Baden-Baden 2025, ISBN 9783756029846
- Woochan Kim, Yonghyun Gwon, Sunho Park, Hyoseong Kim, Jangho Kim: Therapeutic strategies of three-dimensional stem cell spheroids and organoids for tissue repair and regeneration. In: Bioact Mater 19, 2023: 50–74. PDF.
- Christoph Bock, Michael Boutros, J Gray Camp, Laura Clarke, Hans Clevers, Juergen A Knoblich, Prisca Liberali, Aviv Regev, Anne C Rios, Oliver Stegle, Hendrik G Stunnenberg, Sarah A Teichmann, Barbara Treutlein, Robert G J Vries et al: The organoid cell atlas. In: Nat Biotechnol 39, 2021: 13–17. PDF.
- Andrea Lavazza: Human cerebral organoids and consciousness: A double-edged sword. In: Monash Bioeth Rev 38, 2, 2020: 105–128. PDF.
- Andrea Lavazza, Federico Gustavo Pizzetti: Human cerebral organoids as a new legal and ethical challenge. In: J Law Biosci 7, 1, 2020: Isaa005. PDF.
- Andrea Lavazza, Marcello Massimini: Cerebral organoids: Ethical issues and consciousness assessment. In: J Med Ethics 44, 9, 2018: 606–610. PDF.
- Ulrich Bahnsen: Hier wachsen Gehirne. In: Die Zeit 17, 2018: 35–36.
- Jürgen A Knoblich: Minigehirne aus dem Labor. In: Spektrum der Wissenschaft 12, 2017: 30–37.
- Madeline A Lancaster, Jürgen A Knoblich: Organogenesis in a dish: modeling development and disease using organoid technologies. In: Science 345, 6194, 2014: 1247125. doi:10.1126/science.1247125. → Pluripotente Stammzellen können im Prinzip alle Zelltypen hervorbringen. Diese Fähigkeit wird genutzt, um die Entwicklung von Organen oder deren Krankheiten zu modellieren.
- Toshiro Sato, Robert G Vries, Hugo J Snippert, Marc van de Wetering, Nick Barker, Daniel E Stange, Johan H van Es, Arie Abo, Pekka Kujala, Peter J Peters, Hans Clevers: Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. In: Nature 459, 7244, 2009: 262–265.
Remove ads
Weblinks
- Mini-Organe aus dem Labor können Tierversuche ersetzen auf tagesschau.de (22. April 2025)
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
