Lactoperoxidase
Protein in Homo sapiens Aus Wikipedia, der freien Enzyklopädie
Das Enzym Lactoperoxidase (LPO) kommt in den meisten Tieren vor und wird im Menschen von den Brustdrüsen, Speicheldrüsen und Schleimdrüsen der Bronchien ausgeschieden. Es katalysiert die Oxidation von Phenolen und verschiedenen Anionen durch Wasserstoffperoxid. Die Reaktionsprodukte sind hochreaktive Moleküle, die toxisch auf in den Körper eingedrungene Mikroorganismen wirken. LPO ist daher ein Teil des angeborenen (unspezifischen) Immunsystems und ermöglicht die Neutralisierung von Bakterien in der Milch und anderen Schleimhautsekreten.[2][3][4][5][6][7][8][9][10][11]
| Lactoperoxidase | ||
|---|---|---|
| ||
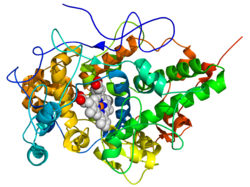
| Bändermodell der Lactoperoxidase der Hausziege (Capra hircus). Das Protein ist in Regenbogenfarben dargestellt (N-Terminus = blau, C-Terminus = rot) während das Häm mit Kugeln dargestellt ist (Kohlenstoff-Atome = weiß, Sauerstoff-Atome = rot, Stickstoff-Atome = blau, Eisenatom = orange).[1] | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 612 aa | |
| Kofaktor | Ca2+, Häm b | |
| Präkursor | (712 aa) | |
| Bezeichner | ||
| Gen-Name | LPO | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.11.1.7, Oxidoreduktase | |
| Reaktionsart | Redoxreaktion | |
| Substrat | Iodid, Bromid, Thiocyanat + H2O2 | |
| Produkte | Hypoiodit, Hypobromit, Hypothiocyanit + H2O | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Tiere | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 4025 | 76113 |
| Ensembl | ENSG00000167419 | ENSMUSG00000009356 |
| UniProt | P22079 | Q5SW46 |
| Refseq (mRNA) | NM_001160102 | NM_080420 |
| Refseq (Protein) | NP_001153574 | NP_536345 |
| Genlocus | Chr 17: 58.24 – 58.27 Mb | Chr 11: 87.81 – 87.83 Mb |
| PubMed-Suche | 4025 | 76113
|
Unter dem Lactoperoxidase-System versteht man die Kombination aus Lactoperoxidase und dessen ionischen Substraten, dem Wasserstoffperoxid sowie den Oxidationsprodukten. Bekannte Substrate sind Bromid- und Iodid-Ionen, aber auch das Thiocyanat-Ion. Die Produkte der enzymkatalysierten Oxidation sind stark antibakteriell wirksam, vermutlich durch Hemmung der Glucose-Aufnahme.[12]
Struktur
Die Struktur der Lactoperoxidase besteht hauptsächlich aus α-Helices. Hinzu kommen zwei kurze antiparallele β-Faltblätter. Ein Häm-Cofaktor befindet sich nahe dem Zentrum des Apoproteins.[1]
Funktion
Zusammenfassung
Kontext
Die Lactoperoxidase katalysiert die Oxidation verschiedener Sauerstoff-Akzeptoren durch Wasserstoffperoxid (H2O2):[13]
- reduzierter Akzeptor + H2O2 → oxidierter Akzeptor + H2O
Beispiele solcher Oxidationsreaktionen sind:
- Thiocyanat (SCN−) → Hypothiocyanit (OSCN−)[14][15]
- Bromid (Br−) → Hypobromit (BrO−)
- Iodid (I−) → Hypoiodit (IO−)
Quelle des Wasserstoffperoxids ist vielfach die Reaktion von Glucose mit Sauerstoff in Gegenwart des Enzyms Glucose-Oxidase (EC 1.1.3.4), die ebenfalls im Speichel stattfindet. Die Glucose wiederum kann in Gegenwart des Speichel-Enzyms Amyloglucosidase (γ-Amylase (EC 3.2.1.3)) aus Stärke entstehen. Derartige Oxidationsprodukte sind hoch reaktiv und antibakteriell stark wirksam.[11][16] Das Lactoperoxidase-System ist in der Lage, eine ganze Reihe von aerobischen[17] und anaerobischen Bakterien,[18] darunter auch mikroaerophile Helicobacter pylori.[19] Der Effekt des Lactoperoxidase-Systems hängt von bestimmten experimentellen Bedingungen ab. Wenn Bakterien unter aerobischen Bedingungen auf Nähragar kultiviert werden sollen, nachdem sie dem Lactoperoxidase-System ausgesetzt waren, wachsen sie nicht. Allerdings wachsen sie sehr wohl auf Blut-Agar unter anaerobischen Bedingungen.[20] Das Lactoperoxidase-System scheint synergistisch mit Lactoferrin[21] und Lysozym[22] zu agieren. Ist Wasserstoffperoxid im Überschuss zum Thiocyanat vorhanden, kann das Lactoperoxidase-System auch cytotoxisch wirken.[20]
Anwendungen
Aufgrund der antibakteriellen Wirksamkeit des Lactoperoxidase-Systems[23] wird es zur Konservierung von Nahrungsmitteln und Kosmetika sowie in der Augenheilkunde eingesetzt. Weitere Anwendungen finden sich in den Bereichen Zahnheilkunde und Wundbehandlung. Möglicherweise kann das Lactoperoxidase-System auch zur Bekämpfung von Tumoren und Viren eingesetzt werden.[24][25][26][27]
Milch und Milchprodukte
Das Lactoperoxidase-System hemmt das Wachstum der bakteriellen Flora in der Milch und in Milchprodukten.[28] Die Zugabe von Wasserstoffperoxid und einem Thiocyanat verlängert die Haltbarkeit gekühlter Rohmilch.[13][29][30][31] Das Lactoperoxidase-System ist vergleichsweise wärmestabil und wird als Indikator für eine Überpasteurisierung von Milch verwendet.[32]
Zahnheilkunde
Das Lactoperoxidase-System scheint auch zur Behandlung von Karies, Gingivitis und Parodontitis geeignet zu sein[33] und wird daher als Bestandteil von Zahnpasten und Mundspüllösungen eingesetzt. Weil es das Bakterienwachstum in der Mundhöhle hemmt, hemmt es auch die Säureproduktion dieser Bakterien.[34]
Klinische Bedeutung des Lactoperoxidase-Systems
Zusammenfassung
Kontext
Zahn- und Mundgesundheit
In den letzten Jahrzehnten sind eine Reihe von klinischen Studien zur Wirksamkeit des Lactoperoxidase-Systems in verschiedenen Mundhygiene-Produkten (Zahnpasten, Mundspüllösungen) veröffentlicht worden. Nachdem indirekt über die Messung experimenteller Gingivitis- und Karies-Parameter gezeigt worden war, dass Mundspüllösungen,[35][36] welche Amyloglucosidase (γ-Amylase) und Glucose-Oxidase enthalten, das Lactoperoxidase-System aktivieren, sind aus jüngster Zeit Studien bekannt, die den Mechanismus der Schutzfunktion von Enzymen in Mundhygieneprodukten beleuchten. So werden Enzyme wie Lysozym, Lactoperoxidase und Glucose-Oxidase von den Zahnpasten auf das Pellikel übertragen. Als Bestandteil des Pellikels sind diese Enzyme katalytisch hoch aktiv.[37][38] Ebenso hat das Lactoperoxidase-System als Bestandteil von Zahnpasten einen günstigen Einfluss auf die Vermeidung frühkindlicher Karies,[39] indem es die Zahl gebildeter Kolonien kariogener Mikroflora herabsetzt, während gleichzeitig die Thiocyanat-Konzentration steigt. Zahnpasten mit dem Lactoperoxidase-System erwiesen sich bei Xerostomie-Patienten im Vergleich zu fluoridhaltigen Zahnpasten hinsichtlich Plaque-Bildung und Zahnfleischentzündungen als überlegen.[40] Weitere Studien dieser Art sollten folgen,[41] nicht zuletzt um den Mechanismus der Schutzwirkung näher zu beleuchten, welcher noch nicht genau aufgeklärt ist.[42] Die Anwendung von Lactoperoxidase ist nicht auf Karies, Gingivitis und Parodontitis beschränkt.[43] So kann eine Kombination aus Lysozym und Lactoperoxidase auch zur unterstützenden Behandlung des Burning Mouth Syndroms (Glossodynie) eingesetzt werden. In Kombination mit Lactoferrin wirkt Lactoperoxidase gegen Mundgeruch,[44] in Kombination mit Lactoferrin und Lysozym trägt Lactoperoxidase zur Linderung von Beschwerden wegen Mundtrockenheit (Xerostomie) bei.[45] Ebenso können Gele mit Lactoperoxidase bei Mundhöhlenkrebs-Patienten, deren Speichelfluss infolge von Bestrahlungen eingeschränkt ist (Xerostomie), zur Symptomlinderung beitragen und gleichzeitig die Bakterienflora günstig beeinflussen.[46][47][48]
Zystische Fibrose
Im Speichel von Patienten mit zystischer Fibrose wird weniger Thiocyanat gefunden als in gesunden Patienten.[49] Weil so auch weniger antibakteriell wirksames Hypothiocyanit gebildet werden kann, könnte dies ein Grund dafür sein, dass diese Patienten gehäuft unter Atemwegserkrankungen leiden.[50][51]
Krebs
Antikörper-Konjugate mit Lactoperoxidase töten Tumorzellen ab.[24] Makrophagen, die Lactoperoxidase ausgesetzt waren, können Tumorzellen verstärkt neutralisieren.[25] Die Oxidation von Estradiol durch Lactoperoxidase wird als mögliche Quelle für oxidativen Stress bei Brustkrebs gehandelt.[52][53][53] Auch Östrogen wird in Gegenwart von Lactoperoxidase oxidiert. Dabei entsteht am phenolischen A-Ring des Östrogens ein reaktives Phenoxy-Radikal.[54] Durch die Einwirkung von Lactoperoxidase könnten carcinogene Amine so aktiviert werden, dass sie vermehrt mit DNS reagieren und so zur Bildung von Brustkrebs beitragen.[55]
Weblinks
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
