Loading AI tools
Bei dem juvenilen Nasenrachenfibrom (englisch juvenile nasopharyngeal angiofibroma, JNA) handelt es sich um einen histologisch gutartigen Tumor, der vom Rachendach ausgeht. Es tritt meist bei männlichen Jugendlichen ab dem 10. Lebensjahr auf. Histologisch handelt es sich um ein Angiofibrom, also ein gefäßreiches Fibrom. Es wächst lokal verdrängend und destruierend in die Nasennebenhöhlen, die Orbita, die Fossa pterygopalatina und die Nase ein. Aus diesem Grund ist sein Wachstumsverhalten als bösartig zu betrachten.
| Klassifikation nach ICD-10 | |
|---|---|
| D10 | Gutartige Neubildung des Mundes und des Pharynx |
| D10.6 | Nasopharynx |
| ICD-10 online (WHO-Version 2019) | |
Juvenile Nasenrachenfibrome sind in westlichen Ländern selten und machen etwa 0,05 % aller HNO-Tumoren aus.[1] In Indien kommen sie etwa 5 Mal häufiger vor.[2]
Es kommt zur Behinderung der Nasenatmung. Es kann außerdem zu eitriger Rhinitis, Tubenfunktionsstörung und damit zu einer Schallleitungsschwerhörigkeit kommen. Die Patienten können ebenfalls über Kopfschmerzen klagen und aufgrund des gut durchbluteten Tumors kommt es zu Nasenbluten, da die dünnwandigen Gefäße schnell zerreißen können.
Bei Schädelbasisinfiltration des juvenilen Nasenrachenfibroms können die Hirnnerven I–VI ausfallen. Wegen der zahlreichen Gefäße können Tumorblutungen zum Beispiel bei einer Gewebeprobe lebensbedrohlich sein. Daher werden vor der definitiven Operation keine Biopsien durchgeführt. Durch Einbruch in die Orbita kann ein Exophthalmus entstehen.
Die Diagnose wird durch die posteriore Rhinoskopie gestellt. Hierbei imponiert ein knolliger, palpatorisch harter, grauroter Tumor von glatter Oberfläche im Nasenrachenraum mit Ausläufern in die Choanen und Gefäßzeichnung an der Oberfläche. Ebenfalls kommen bildgebende Verfahren wie die Magnetresonanztomographie und bei Verdacht auf Knochendestruktion die Computertomographie zum Einsatz. Eine Angiographie mit Embolisation des Tumors kann durchgeführt werden, um die Blutungsgefahr zu senken. Wegen des hohen Blutungsrisikos des Tumors wird keine Biopsie des Tumors entnommen.
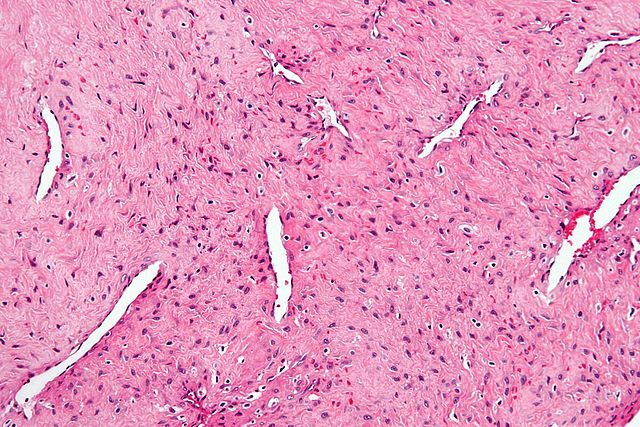
Das histologische Bild wird von dünnwandigen Gefäßen ohne Myozyten und Bindegewebszellen geprägt. Zur Molekularbiologie gibt es noch wenig Daten. Es wurde eine erhöhte Expression von c-myc, VEGF, bFGF, PDGF, c-kit, H-Ras und TP53 beobachtet. Auch β-Catenin war überexprimiert.[3] Es bestehen Hinweise, dass das biologische Verhalten durch molekularbiologische Eigenschaften beeinflusst wird. Eine erhöhte Expression von VEGF war mit einer Invasion der Schädelbasis und vermehrter Blutungsneigung assoziiert. Die Befunde müssen jedoch noch an größeren Kollektiven bestätigt werden.[4]
Es wurden zahlreiche Stadieneinteilungen publiziert.[5] Eine häufig verwendete ist die von Radkowski:[6]
| Stadium | Ausdehnung | Bemerkungen |
|---|---|---|
| IA | Tumor beschränkt auf die Nase oder den Nasopharynx | |
| IB | Ausbreitung in eine oder mehrere Nasennebenhöhlen | |
| IIA | Minimale Ausdehnung durch das Foramen sphenopalatinum, geringer, medialer Teil der Fossa pterygopalatina | |
| IIB | Ausgedehnte Beteiligung der Fossa pterygopalatina, Verlagerung der hinteren Wand der Maxilla. Laterale oder ventralen Verlagerung von Ästen der Arteria maxillaris. Ausdehnung nach cranial mit Erosion des Orbitabodens. | |
| IIC | Ausdehnung durch die Fossa pterygopalatina in die Weichteile der Wange, in die Fossa temporalis oder nach dorsal zum Processus pterygoideus | |
| IIIA | Erosion der Schädelbasis mit minimaler intracranialer Ausdehnung | |
| IIIB | Erosion der Schädelbasis mit ausgedehnter intracranialer Beteiligung. Mit oder ohne Befall des Sinus cavernosus. | Meistens inoperabel. Mit Strahlentherapie kontrollierbar.[7] |
Bei großen Befunden ist eine Operation indiziert. Die Operation kann offen oder endoskopisch erfolgen.[8] Die endoskopische Resektion wird bevorzugt eingesetzt, weil weniger postoperative Komplikationen beobachtet wurden als bei offener Resektion.[9] Vorhergehend sollte, wenn möglich, eine Embolisation des Tumors durchgeführt werden, um die Blutungsgefahr zu vermindern. Diese kann zum Beispiel durch superselektive Injektion von Polyvinylalkohol 24 bis 72 Stunden vor der Operation erfolgen.[9] Die Bestrahlung sollte nur bei inoperablen Tumoren durchgeführt werden. Wegen der Nähe von Risikoorganen (Gehirn, Auge, Sehnerv, Hirnnerven, Ohr) sollten moderne Techniken wie IMRT zur Anwendung kommen. Mit Gesamtdosen von 40 bis 46 Gy konnten gute Ergebnisse erzielt werden.[7] Das juvenile Nasenrachenfibrom kann sich nach der Pubertät spontan zurückbilden.
Die erste Beschreibung eines juvenilen Nasenrachenfibrom findet sich bei Hippokrates, der ein JNA mittels Längsspaltung der Nase entfernte.[10] Die erste moderne Beschreibung und Namensgebung erfolgte durch Chauveau.[11]
- P. Nagel: Basics Hals-Nasen-Ohren-Heilkunde. Urban & Fischer, Elsevier 2005, ISBN 3-437-42176-X, S. 80.
- A. Franzen: Hals-Nasen-Ohrenheilkunde: Kurzlehrbuch für den GK 3. Urban & Fischer, Elsevier 2001, ISBN 3-437-42960-4, S. 16.
- Lenarz, Boenninghaus: HNO. 14. Auflage. Springer, 2012, ISBN 978-3-642-21130-0, S. 256.
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.