Gelbfieber-Virus
Art der Gattung Flavivirus Aus Wikipedia, der freien Enzyklopädie
Das Gelbfieber-Virus (auch Gelbfiebervirus, englisch Yellow Fever Virus, kurz YFV; Spezies Orthoflavivirus flavi) ist ein Virus,[3][4] das in Menschen und anderen Primaten ein hämorrhagisches Fieber, das so genannte Gelbfieber, auslösen kann. Das Virus wird durch Stechmücken verschiedener Gattungen (unter anderem Aedes, Haemagoggus und Sabethes) übertragen. Beim Stechen eines infizierten Primaten nimmt die Mücke das Virus auf, das sich dann in der Mücke weiter vermehrt und die Speicheldrüsen infiziert. Über den Speichel wird es beim nächsten Stich weitergegeben.
| Gelbfieber-Virus | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

Gelbfieber-Virus | ||||||||||||||||||||
| Systematik | ||||||||||||||||||||
| ||||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||||
| ||||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||||
| Yellow fever virus | ||||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||||
| YFV | ||||||||||||||||||||
| Links | ||||||||||||||||||||
|
Das Gelbfieber-Virus gehört zu der Familie Flaviviridae (Flaviviren), deren Mitglieder typischerweise eine einzelsträngige RNA mit positiver Polarität als Genom besitzen, das von einem sphärischen Kapsid umgeben ist. Das Kapsid wird von einer von der Wirtszelle abgeleiteten Membran umhüllt, in welche die strukturellen Proteine M und E eingelagert sind. Insbesondere das Protein E ist prominent auf der Oberfläche des Virions (Virusteilchens) und wirkt deshalb als Antigen.
Sowohl der Name der Gattung Orthoflavivirus als auch der Name der ganzen Familie Flaviviridae und das Art-Epitheton flavi leiten sich vom Gelbfieber-Virus ab (von lateinisch flavus ‚gelb‘).
Systematik
Das Gelbfieber-Virus YFV ist der Referenzstamm (englisch exemplar) der Art Orthoflavivirus flavi, und namensgebende (charakterierende) Art der Familie Flaviviridae, welche neben der Gattung Orthoflavivirus noch die Gattungen Pegivirus, Pestivirus und Hepacivirus enthält (Stand 27. März 2024). Zur Gattung Orthoflavivirus gehören über 50 Virusspezies, wobei das Gelbfiebervirus (bzw. die Art Orthoflavivirus flavi) in die Kategorie der von Stechmücken übertragenen Viren fällt, also zu den Arboviren klassifiziert wird. Es bildet zusammen mit dem Banzi-Virus, dem Bouboui-Virus, dem Edge-Hill-Virus, dem Jugra-Virus, dem Saboya-Virus, dem Sepik-Virus, dem Uganda-S-Virus und dem Wesselsbron-Virus die „Gelbfiebervirus-Gruppe“. Alle diese Viren stammen aus der alten Welt, benutzen Mücken der Gattung Aedes als Vektoren und infizieren Säugetiere.[5]
Wegen seiner genetischen Stabilität ist nur ein Serotyp bekannt.[6]
Struktur


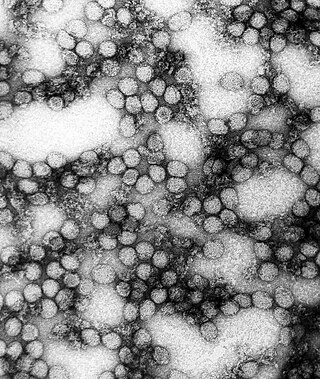
Die Virionen (Virusteilchen) des YFV sind sphärisch und haben einen Durchmesser von ungefähr 40–50 nm. Das Genom liegt mit dem dimerisierten Kapsidprotein C komplexiert als Nukleokapsid vor. Das Kapsid wird von einer von der Wirtszelle abgeleiteten Membran umhüllt, in welche die strukturellen Proteine M und E eingelagert sind. Insbesondere das Protein E ist prominent auf der Oberfläche des Virions und wirkt deshalb als Antigen, wobei 12 Epitope alleine auf dem Protein E identifiziert werden konnten. Das Protein besteht aus drei Domänen, wobei Antikörper vor allem gegen die an der Oberfläche liegende DIII als auch gegen die funktional wichtige fusion loop auf DII gebildet werden.[7]
Andere Viren der Gattung Orthoflavivirus haben eine ikosaedrische Symmetrie, deshalb wird auch für das Gelbfiebervirus eine entsprechende Struktur angenommen. Im infektiösen Virion würden die 90 E-Dimere eine pseudo-ikosaedrische Struktur mit Triangulationszahl T = 3 bilden.[7]
Genom
Das RNA-Genom liegt mit dem dimerisierten Kapsidprotein C komplexiert als Nukleokapsid vor. Die positivsträngige RNA ist 11.862 Nukleotide lang, sie weist eine 5'-Cap-Struktur auf und am 5'- und 3'-Ende finden sich nichtkodierende Nukleotide mit einer Länge von 118 bzw. 511 Basen.[8] Der offene Leserahmen ist 10.233 Nukleotide lang, er kodiert für ein 3411 Aminosäuren langes Polyprotein.[8]
Proteasen schneiden dieses Polyprotein in die drei strukturellen (C, prM[9], E) und in die sieben nicht-strukturellen Proteine (NS1, NS2A, NS2B, NS3, NS4A, NS4B, NS5); die Aufzählung entspricht der Anordnung der für die Proteine codierenden Gene auf dem Genom.[10]
Das Genom des Impfvirus 17D unterscheidet sich gegenüber dem Wildtyp in 68 Nukleotiden, wodurch 32 Aminosäuren der viralen Proteine verändert sind.[11] Hierbei ist insbesondere das strukturelle Protein E betroffen.[12]
Replikation
Zusammenfassung
Kontext
Die Viren infizieren unter anderem Monozyten, Makrophagen und dendritische Zellen. Sie heften sich über bisher noch nicht identifizierte Rezeptoren an der Zelloberfläche an und werden durch ein sich ausbildendes Endosomvesikel via Clathrin und Rab5 vermittelte Endozytose aufgenommen. Im Innern des Endosoms induziert der saure pH die Fusion von Endosommembran und Virushülle. Dadurch gelangt das Kapsid in das Zytosol, zerfällt und gibt das Genom frei. Sowohl die Rezeptorbindung als auch die Membranfusion werden durch das Protein E katalysiert, das bei saurem pH-Wert seine Konformation ändert, was dazu führt, dass sich die 90 Homodimere irreversibel zu 60 Homotrimeren neu organisieren.[10] Dabei wird die hoch konservierte hydrophile fusion loop (Domäne 2, DII) des E Proteins an die Oberfläche des Virions gebracht. Diese Domäne insertiert sich in die Wirtsmembran und das Protein E faltet sich zurück auf sich selbst, was die beiden Membranen in direkten Kontakt bringt.[7]
Nach dem Eindringen in die Wirtszelle wird das virale Genom im rauen ER und in so genannten vesicle packets repliziert. Innerhalb des ER wird zuerst eine unreife Form der Viruspartikel produziert, bei der das M-Protein noch nicht durch einen Reifungsschritt gespalten wurde und als prM (precursor M) in einem Komplex mit E vorliegt. Die unreifen Partikel werden im Golgi-Apparat durch das Wirtsprotein Furin prozessiert, welches prM zu M schneidet. Dadurch wird E aus dem Komplex mit M entlassen, dimerisiert und kann seinen Platz im reifen (maturen), infektiösen Virion einnehmen.[10]
Aufgrund der Mutationen im Protein E-kodierenden Bereich des Impfstammes 17D vermutet man, dass sich das Impfvirus schlechter an die Rezeptoren der Leberzellen binden und diese infizieren kann. Infolgedessen verläuft die Infektion langsamer und abgeschwächter.[11]
Nichtstrukturelle Proteine

Das Gelbfiebervirus hat sieben nichtstrukturelle Proteine, deren Funktion erst teilweise verstanden ist.
Die virale Protease ist eine Serinprotease mit His-Asp-Ser als katalytische Triade und besteht aus den Untereinheiten NS2B und NS3. Daneben hat NS3 auch eine Helikase / NTPase Aktivität, die sehr wahrscheinlich benötigt wird, um Sekundärstrukturen in der RNA aufzulösen, damit die RNA-Replikation vonstattengehen kann. Weiterhin ist NS3 notwendig um die 5'-Cap-Struktur am Beginn der viralen RNA zu erstellen.[10]
Bei der viralen RNA-dependent RNA polymerase (RdRP) handelt es sich um das Protein NS5. Dieses Protein ist als Angriffsziel für antivirale Medikamente geeignet, da menschliche Zellen keine äquivalente Proteine besitzen (die Replikation von RNA findet in eukaryotischen Zellen normalerweise nicht statt). Weiterhin hat NS5 auch eine Methyltransferase-Domäne, welche die 5'-Cap-Struktur am N7 sowie das erste Nukleotid am O2 methyliert.[10]
Meldepflicht
In Deutschland ist der direkte oder indirekte Nachweis des Gelbfiebervirus namentlich meldepflichtig nach § 7 des Infektionsschutzgesetzes, soweit der Nachweis auf eine akute Infektion hinweist.
In der Schweiz ist der positive und negative laboranalytische Befund zum Gelbfiebervirus meldepflichtig und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 3 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen.
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.