Remove ads
Die Chloraniline bilden in der Chemie eine Stoffgruppe, die sich sowohl vom Anilin als auch vom Chlorbenzol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter Aminogruppe (–NH2) und Chlor (–Cl) als Substituenten. Durch deren unterschiedliche Anordnung (ortho, meta oder para) ergeben sich drei Konstitutionsisomere mit der Summenformel C6H6ClN. Daneben existiert auch noch das isomere N-Chloranilin.
Je nach Anzahl der Chloratome (einem, zwei, drei, vier oder fünf) unterscheidet man zudem zwischen Mono-, Di-, Tri-, Tetra- und Pentachloranilinen.
Remove ads
| Chloraniline | ||||||
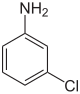
| Name | 2-Chloranilin | 3-Chloranilin | 4-Chloranilin | |||
| Andere Namen | o-Chloranilin | m-Chloranilin | p-Chloranilin | |||
| Strukturformel |  |
 |
 | |||
| CAS-Nummer | 95-51-2 | 108-42-9 | 106-47-8 | |||
| PubChem | 7240 | 7932 | 7812 | |||
| Summenformel | C6H6ClN | |||||
| Molare Masse | 127,57 g·mol−1 | |||||
| Aggregatzustand | flüssig | fest | ||||
| Kurzbeschreibung | farblose bis gelbliche Flüssigkeit mit aromatischem Geruch[1][2] |
farbloser bis gelblicher kristalliner Feststoff mit schwach aromatischem Geruch[3] | ||||
| Schmelzpunkt | −3 °C[1] | −10 °C[2] | 70 °C[3] | |||
| Siedepunkt | 209 °C[1] | 230 °C[2] | 232 °C[3] | |||
| Dichte | 1,21 g/cm3[1] | 1,22 g/cm3[2] | 1,43 g/cm3[3] | |||
| Dampfdruck (bei 20 °C) | 0,13 mbar[1] | 0,03 mbar[2] | ||||
| pKs-Wert[4] (der konjugierten Säure BH+) |
2,65 | 3,52 | 4,00 | |||
| Löslichkeit | schwer löslich in Wasser (3–6 g/l)[1][2][3] | |||||
| GHS- Kennzeichnung |
| |||||
| H- und P-Sätze | 331‐311‐301‐319‐373‐410[1] | 301+311+331‐373‐410[2] | 301‐311‐317‐331‐350‐410[3] | |||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||
| 261‐273‐280‐301+310‐330‐403+233[1] | 273‐280‐301+310+330‐302+352+312‐304+340+311‐314[2] | 201‐280‐302+350‐304+340‐308+313‐273[3] | ||||
| MAK | Schweiz: 0,04 ml·m−3 bzw. 0,2 mg·m−3 (gemessen als einatembarer Staub)[5] | |||||
Remove ads
Das 4-Chloranilin, das die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt. Alle Verbindungen dieser Gruppe werden als giftig und umweltgefährlich eingestuft.[6] Chloraniline werden meist als Zwischenprodukte zur Synthese anderer chemischer Verbindungen wie Pflanzenschutzmittel, Farbstoffe und Arzneistoffe eingesetzt. Da beim natürlichen Abbau einiger dieser Stoffe die bei der Synthese eingesetzten Chloraniline freiwerden (bzw. auch bei unsachgemäßer Produktion), sind Spuren der Verbindungen (in den letzten Jahrzehnten in immer geringer werdendem Maße) in Grundwasser und Flüssen zu finden.[7][8] Der Nachweis der Stoffe kann über Flüssigchromatographie erfolgen.[9]
Remove ads
Chloraniline werden meist als Zwischenprodukte zur Synthese anderer chemischer Verbindungen wie Pflanzenschutzmittel, Farbstoffe und Arzneistoffe eingesetzt. 4-Chloranilin darf nach reduktiver Spaltung von Azogruppen nicht von Textilien oder Ledererzeugnissen, die längere Zeit mit der menschlichen Haut direkt in Berührung kommen, freigesetzt werden (Anlage 1 der Bedarfsgegenständeverordnung).
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
Remove ads


