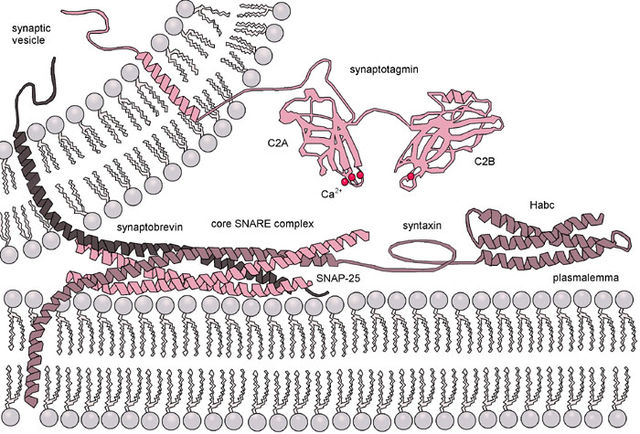
Synaptotagmine sind eine Gruppe von 17 an Zellmembranen lokalisierten Proteinen, die sich durch eine N-terminale Transmembranregion (TMR), eine variable Verbindung und zwei C-terminale C2-Domänen (C2A und C2B) auszeichnen. Es gibt mehrere C2-Domänen-tragende Proteingruppen, die mit Synaptotagminen verwandt sind, darunter Ferline, E-Syts und MCTPs, sowie RIMs, Munc13s und B/K.
Funktion
Auf der Grundlage ihrer endokrinen Verteilung im Gehirn und ihrer biochemischen Fähigkeiten, binden C2-Domänen der Synaptotagmine Calcium. Es wird daher angenommen, dass Synaptotagmine als Calciumsensoren dienen, die die Freisetzung von Neurotransmittern und Hormonen steuern.
Obwohl alle Synaptotagmine sehr ähnlich strukturiert sind, binden nur acht (1, 2, 3, 5, 6, 7, 9, und 10) Calcium.
Proteine aus der Gruppe der Synaptotagmine finden sich durch die Interaktion mit β-neurexin[1] bzw. SNAP-25[2] in der Exozytose in der frühen (Andocken der synaptischen Vesikel an der präsynaptischen Membran) und in der späten Phase.[3][4][5]
2006 konnte in einem Versuch gezeigt werden, dass Synaptotagmin 1 in der Anwesenheit von Calcium Complexin aus dem SNARE-Komplex verdrängen kann. Dies wird als eine der letzten chemischen Reaktionen bei der Exozytose betrachtet.[6]
Die C2-Domänen steuern dann die Fusion der synaptischen Vesikel im Rahmen der Exozytose.[7][8]
Einzelnachweise
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
