Loading AI tools
Synthesestrategie in der anorganischen Chemie Aus Wikipedia, der freien Enzyklopädie
Die Solvothermalsynthese ist eine Synthesestrategie in der anorganischen Chemie. Dazu wird das Lösungsmittel mit den Edukten in einem Autoklav unter hohen Druck (und hohen Temperaturen) gesetzt. In einem derartigen Lösungsmittel lösen sich viele Stoffe besser als unter Normalbedingungen, so dass Reaktionen möglich sind, die sonst nicht stattfinden würden. Dadurch ist es möglich neue Verbindungen oder Modifikationen darzustellen. Die Solvothermalsynthese kann auch als Spezialfall einer chemischen Transportreaktion angesehen werden.[1]
Byrappa and Yoshimura definierten die Solvothermalsynthese als: " [...] any heterogeneous chemical reaction in the presence of a solvent (whether aqueous or nonaqueous) above room temperature at a pressure greater than 1 atm in a closed system." (dt.: " [...] jede heterogene chemische Reaktion, die in Gegenwart eines Lösungsmittels (sei es wässrig oder nicht) über Raumtemperatur und mit einem Druck größer als eine Atmosphäre abläuft).[2]
Der erste Hinweis auf eine geglückte Solvothermalsynthese findet sich 1845 bei Schafhäutl, der Quarzkristallite aus frisch gefällter Kieselsäure in einem Papin’schen Topf gewinnen konnte. Bunsen gelang es 1848 mit Hilfe dickwandiger Glas- bzw. Barometherröhren und dem Abkühlen einer 200 °C heißen unter 15 bar Druck stehenden ammoniakalischen Lösung Kristallnadeln verschiedener Carbonate zu gewinnen (dieses Verfahren ist der Vorläufer der visuellen Hydrothermalsynthese). Die moderne Form der Hydrothermalsysnthese wurde von de Sénarmont 1851 erfunden, dieser verwendete als Reaktionsgefäß abgeschmolzene Glasampullen, die in einen Autoklaven eingebracht wurden um Explosionen zu vermeiden. So wurden bis 1900 circa 80 silicatische Mineralien synthetisiert. Das Aufkommen neuer Legierungen führte zu mit Edelmetallen ausgekleideten Autoklaven, die neuen Reaktionsmedien gerecht wurden. Heute verwendet man hauptsächlich die von Morey 1914 angegebene Anordnung (für Arbeiten bis 400 °C und 400 bar), die Tuttle-"cold seal"-Anordnung (1949; für Arbeiten bis 900 °C und 2000 bar bei Verwendung von Legierungen auf Cobalt- oder Nickelbasis) oder der von Smith und Adams 1923 entwickelte innenbeheizte Autoklav (mit wassergekühltem Stahlmantel), der sich für Arbeiten bis 1400 °C und 10.000 bar eignet.[1]

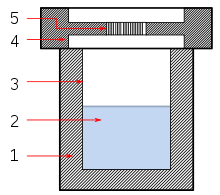
In der Regel erfordert die Solvothermalsynthese den Einsatz von Autoklaven. Ein Autoklav dient dem Schutz des Reaktionsgefäßes, wobei der Autoklav häufig selbst das Reaktionsgefäß ist. Für Arbeiten bis 400 °C und 400 bar eignet sich die Anordnung von Morey am besten. Diese Anordnung besteht aus einem Autoklavenmantel, in welchem sich das Reaktionsgefäß befindet. Das Reaktionsgefäß wird in den unteren Teil des Autoklavenmantels gestellt und mit einem sechskantigen Verschlussteil verschlossen. Das Material des Mantels ist häufig Werkzeugstahl, es ist möglich, das innere komplett mit Edelmetallen auszukleiden, sodass die Reaktionen im Autoklav selbst durchgeführt werden können, auch ist es möglich Ampullen als Reaktionsgefäße einzubringen. Der gesamte Autoklav befindet sich in einem Ofen und wird erhitzt.[1]
Der Tuttle-"cold seal"-Autoklav besteht aus einem Stahlzylinder, in welchem ein Loch gedreht wurde. Dieses Ende taucht in den Ofen ein, der Schraubdeckel mit konischer Dichtung befindet sich außerhalb des Ofens (häufig mit Wasserkühlung, um eine hinreichend niedrige Temperatur zu erzielen). Der Druck im Tuttle-"cold seal"-Autoklav muss von außen angelegt werden, das Reaktionsgefäß ist immer eine Ampulle (häufig aus Glas oder einem Edelmetall). Diese Anordnung ist bis 750 °C und 5000 bar verwendbar. Der Arbeitsbereich kann ausgedehnt werden, in dem spezielle Legierungen für den Mantel verwendet werden (z. B. Legierungen auf Cobalt- und Nickelbasis).[1]
Für die meisten Anwendungen sind die Anordnungen von Tuttle und Morey hinreichend gut geeignet. Sind für eine Synthese noch höhere Temperaturen erforderlich so muss die Heizung in das innere eines wassergekühlten Stahlmantels verlegt werden. Diese Anordnung wurde zum ersten Mal 1923 von Smith und Adams beschrieben.[1]
Der Werkstoff des Reaktionsgefäßes muss einige wichtige Eigenschaften aufweisen, um für die Hochtemperatur/-druck Anwendung geeignet zu sein. So muss er Korrosionsbeständig gegenüber dem verwendeten Lösungsmittel und den Reaktionsbedingungen sein, außerdem darf er die Reaktionsprodukte nicht kontaminieren.
Neben Wasser (Hydrothermalsynthese) als wichtigstem solvothermalen Reaktionsmedium gibt es eine große Anzahl von verwendeten Lösungsmitteln, so unter anderem: Methanol, Ammoniak (Ammonothermalsynthese), Kohlenstoffdioxid oder Glycole (z. B. mit 1,6-Hexandiol, Glycothermalsynthese genannt).[1][2]
Die pVT-Daten von Wasser sind bis 1000 °C und 10 kbar hinreichend bekannt. Wichtige Eigenschaften von Wasser bei hohen Drücken und Temperaturen sind unter anderem die vollständige Dissoziation in H3O+ und OH− bei circa 150–200 kbar und 1000 °C; die mit steigender Temperatur und steigendem Druck abnehmende Viskosität und die mit steigender Temperatur abnehmenden und mit steigendem Druck zunehmende Dielektrizitätskonstante.[1]
Ameisensäure zersetzt sich bei hohen Temperaturen zu Kohlenstoffdioxid und Wasserstoff bzw. zu Kohlenstoffmonoxid und Wasser. Damit wandelt sich die Ameisensäure zu einem reduzierenden und Kohlenstoffdioxid-reichen Reaktionsmedium, in welchem es möglich ist, zahlreiche Oxide und Carbonate zu gewinnen.[1]
Die kritische Temperatur von Ammoniak liegt bei 132,2 °C und der kritische Druck bei 111 bar. Bei solchen Bedingungen ist es gut möglich eine ganze Reihe von Amiden, Imiden und Nitriden zu gewinnen. Auch wenn die Dielektrizitätskonstante von Ammoniak niedriger ist als die von Wasser, so erscheint es doch, gerade bei hohen Drücken, als polares Medium.[1]
Wichtige Anwendungsgebiete der Solvothermalsynthese sind:[1]
| Parameter | SiO2 | GaN |
|---|---|---|
| Autoklavengröße | 0,65 m Durchmesser
14 m Länge |
3 cm Durchmesser
20–70 cm Länge |
| Autoklavenvolumen | 4,6 m3 | 0,0004 m3 |
| Maximale Ausbeute pro Durchlauf | 2,3 t | wenige Gramm |
Hochdurchsatz-Methoden (HD-Methoden) sind ein Teilbereich der kombinatorischen Chemie und ein Werkzeug zur Effizienzsteigerung. Grundsätzlich gibt es zwei Synthesestrategien innerhalb der HD-Methoden:[3]
Hochdurchsatz-Solvothermalsynthesen laufen lösungsmittelbasiert ab.[3]
Hochdurchsatz-Synthesemethoden werden bei der Entdeckung neuer, analoger oder isoretikulärer Metallorganischen Gerüstverbindungen (engl. Metal Organic Frameworks, MOFs) eingesetzt. Dabei wird eine große Anzahl von Reaktionen mit unterschiedlichen Bedingungen (Lösungsmittel- und Edukt- bzw. Additivverhältnisse) parallel durchgeführt und anschließend die Kristallinität und Phasenreinheit der Reaktionsprodukte untersucht. Zur Parallelsynthese werden spezielle Reaktoren eingesetzt (siehe dazu auch den Abschnitt zu HD-Methoden im Artikel zu den Metallorganische Gerüstverbindungen). Synthesen, die kristalline Produkte ergeben, werden dann im präparativen Maßstab wiederholt und die Produkte weitergehend analysiert.[3][4]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.