Loading AI tools
Die Dichlorbenzole bilden in der Chemie eine Stoffgruppe, bestehend aus einem Benzolring mit zwei Chloratomen (–Cl) als Substituenten. Durch deren unterschiedliche Anordnung (ortho, meta oder para) ergeben sich drei Konstitutionsisomere mit der Summenformel C6H4Cl2.
| Dichlorbenzole | ||||||||||
| Name | 1,2-Dichlorbenzol | 1,3-Dichlorbenzol | 1,4-Dichlorbenzol | |||||||
| Andere Namen | o-Dichlorbenzol 1,2-Dichlorbenzen | m-Dichlorbenzol 1,3-Dichlorbenzen | p-Dichlorbenzol 1,4-Dichlorbenzen | |||||||
| Strukturformel |  |
 |
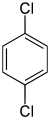 | |||||||
| CAS-Nummer | 95-50-1 | 541-73-1 | 106-46-7 | |||||||
| 25321-22-6 (Isomerengemisch) | ||||||||||
| PubChem | 7239 | 10943 | 4685 | |||||||
| Summenformel | C6H4Cl2 | |||||||||
| Molare Masse | 147,00 g·mol−1 | |||||||||
| Aggregatzustand | flüssig | fest | ||||||||
| Kurzbeschreibung | farblose Flüssigkeit mit unangenehmem Geruch[1] |
farblose Flüssigkeit mit charakteristisch aromatischem Geruch[2] |
weißer kristalliner Feststoff mit kampferartigem Geruch[3] | |||||||
| Dichte | 1,32 g·cm−3 (20 °C)[1] | 1,29 g·cm−3 (20 °C)[2] | 1,248 g·cm−3 (20 °C)[3] | |||||||
| Schmelzpunkt | −18 °C[1] | −22 °C[2] | 53 °C[3] | |||||||
| Siedepunkt | 179 °C[1] | 173 °C[2] | 174 °C[3] | |||||||
| Dampfdruck (20 °C) | 1,33 hPa[1] | 2,4 hPa[2] | ||||||||
| Löslichkeit | 0,08 g·l−1 (20 °C)[1] | 0,11 g·l−1 (20 °C)[2] | 0,049 g·l−1 (20 °C)[3] | |||||||
| praktisch unlöslich in Wasser, löslich in organischen Lösungsmitteln | ||||||||||
| Flammpunkt | 70 °C[1] | 63 °C[2] | 66 °C[3] | |||||||
| Untere Explosionsgrenze (UEG) | 1,7 Vol%[1] | 1,7 Vol%[3] | ||||||||
| 103 g·m3[1] | ||||||||||
| Obere Explosionsgrenze (OEG) | 12 Vol%[1] | 5,9 Vol%[3] | ||||||||
| 735 g·m3[1] | ||||||||||
| Maximaler Explosionsdruck | 6,9 bar[1] | |||||||||
| Zündtemperatur | 640 °C[1] | >500 °C[2] | 640 °C[3] | |||||||
| Temperaturklasse | T1 | |||||||||
| GHS- Kennzeichnung |
|
|
| |||||||
| H- und P-Sätze | 302+332‐315‐317 319‐335‐410 |
302‐411 | 319‐351‐410 | |||||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||||||
| 273‐280‐301+312 304+340+312‐305+351+338[1] |
273[2] | 273‐280‐305+351+338 308+313[3] | ||||||||
| MAK | Schweiz: 10 ml·m−3 bzw. 61 mg·m−3[4] | Schweiz: 2 ml·m−3 bzw. 12 mg·m−3[5] | Schweiz: 2 ml·m−3 bzw. 12 mg·m−3[6] | |||||||
Wird Benzol direkt mit Chlor in Gegenwart einer Lewissäure wie z. B. Eisen(III)-chlorid oder Aluminiumchlorid umgesetzt, ergibt sich als Hauptprodukt Chlorbenzol in 80–90%iger Ausbeute. Die o- und p-Dichlorbenzole fallen bei dieser Reaktion nur in geringen Mengen als Nebenprodukte an.
Wird die Menge des eingesetzten Chlorierungsmittels deutlich erhöht, so können größere Mengen p-Dichlorbenzol neben o-Dichlorbenzol und wenig m-Dichlorbenzol gewonnen werden. Weiterhin entstehen auch Chlorbenzol und die höher chlorierten Benzole (z. B. Trichlorbenzole).
o-Dichlorbenzol und m-Dichlorbenzol sind farblose ölige Flüssigkeiten mit stechendem Geruch; p-Dichlorbenzol (auch Paradichlorbenzol (PDCB) genannt) ist ein Feststoff mit starkem Geruch. Der Stoff befindet sich heute weltweit in der Luft und im Wasser und ist biologisch schwer abbaubar.
Dichlorbenzole sind praktisch unlöslich in Wasser, aber löslich in organischen Lösungsmitteln. Die Siedepunkte der drei Isomere liegen relativ nah beieinander, während sich ihre Schmelzpunkte deutlicher unterscheiden. Das p-Dichlorbenzol, welches die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt.
Dichlorbenzole finden zunehmend Anwendung als Edukte und Zwischenprodukte für Pharmazeutika, Pflanzenschutzmittel, Farbstoffe und Schädlingsbekämpfungsmittel. Sie dienen als Lösungsmittel für Lacke, Gummi, Wachse, Harze und Desinfektionsmittel.
Der größte Teil des hergestellten o-Dichlorbenzols wird durch Nitrierung zu 3,4-Dinitrochlorbenzol weiterverarbeitet. Die Substanz findet auch Verwendung als inertes Lösungsmittel bei der Herstellung von Isocyanaten.[7] Das m-Dichlorbenzol wird ausschließlich als chemisches Zwischenprodukt verwendet.
Für das p-Dichlorbenzol (PDCB), das als Nebenprodukt anfällt, wurden in der Vergangenheit einige sehr umstrittene Einsatzgebiete gefunden. In vielen WC-Steinen wurde der Stoff mittlerweile durch alternative Stoffe ersetzt. In Steinen für Urinale in der Gastronomie wird es aber heute noch verwendet, da es stark, entfernt himbeerartig, riecht. Die Substanz hat jedoch keine keimtötende Wirkung. Auch in Mottenkugeln[8] und Pestiziden findet PDCB noch Verwendung.[9]
p-Dichlorbenzol ist ein in der Umwelt schlecht abbaubarer Stoff. Es ist giftig für Wasserorganismen (WGK 2[3]) und kann daher längerfristig schädliche Wirkungen haben. Im tierischen Organismus wirkt PDCB schädlich, indem es vorzugsweise Leber, Nieren und Lungen angreift. Auch reizt es Haut und Augen. In neueren Untersuchungen erwies sich Paradichlorbenzol als krebserregend (karzinogen/kanzerogen).[9]
1,2-Dichlorbenzol wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von 1,2-Dichlorbenzol waren die Besorgnisse bezüglich hoher (aggregierter) Tonnage und weit verbreiteter Verwendung sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der CMR-Stoffe. Die Neubewertung fand ab 2013 statt und wurde von Ungarn durchgeführt.[10]
Commons: Dichlorbenzole – Sammlung von Bildern, Videos und Audiodateien
- Patent EP1415964B1: Verfahren zur Trennung von m- und p-Dichlorbenzol enthaltenden Gemischen. Angemeldet am 24. Oktober 2003, veröffentlicht am 13. Februar 2013, Anmelder: Lanxess Deutschland GmbH, Erfinder: Gültekin Erdem et al.
- Patentanmeldung WO0110804A2: Verfahren zur Herstellung von gegebenenfalls substituierten Dichloraromaten. Angemeldet am 24. Juli 2000, veröffentlicht am 15. Februar 2001, Anmelder: Bayer AG, Erfinder: Rüdiger Schubart (Herstellung von Dichloraromaten in Gegenwart von Lewissäuren und HCl).
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.


