Rydbergs formel
From Wikipedia, the free encyclopedia
Rydbergs formel beskriver emissionsspektret fra brint og brint-lignende ioner. Den udsendte bølgelængde er for brint givet ved:
hvor er Rydbergs konstant, mens og er positive heltal. For brint-lignende ioner, hvor der stadig kun er én elektron, men kernen har en ladning på elementarladninger, er formlen givet ved:
Formlen blev formuleret af den svenske fysiker Johannes Rydberg i 1888.[1]
Serier
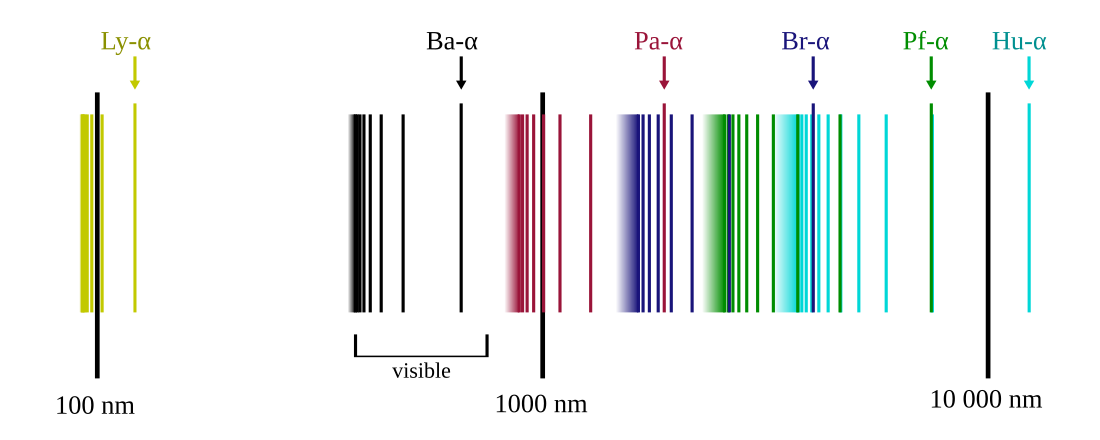
Ved at sætte lig med en bestemt værdier kan forskellige tidligere spektralserier udledes:[2][3]
| Navn | Konvergerer imod | ||
|---|---|---|---|
| 1 | 2 – ∞ | Lyman-serien | 91.13 nm (UV) |
| 2 | 3 – ∞ | Balmer-serien | 364.51 nm (Synligt) |
| 3 | 4 – ∞ | Paschen-serien | 820.14 nm (Infrarødt) |
| 4 | 5 – ∞ | Brackett-serien | 1458.03 nm (Fjerninfrarødt) |
| 5 | 6 – ∞ | Pfund-serien | 2278.17 nm (Fjerninrarødt) |
| 6 | 7 – ∞ | Humphreys-serien | 3280.56 nm (Fjerninrarødt) |
Serierne konvergerer, fordi det andet led i Rydbergs formel går mod nul, når går mod uendelig.
Udledning
Rydbergs formel er lige til at udlede fra Bohrs atommodel. I den kan elektronerne kun antage diskrete energiniveauer givet ved:
hvor igen er et positivt heltal. I formlen er elementarladningen, er elektronens masse, er vakuumpermittiviteten, og er Plancks reducerede konstant. Hvis en elektron nu går fra en høj tilstand til en lav tilstand , er energiændringen givet ved:
Energien frigives i form af en foton, hvis energi er proportional med frekvensen :
Her er Plancks konstant. Frekvensen er lysets fart divideret med , så
eller
Dermed er Rydbergs formel udledt, hvor Rydbergs konstant altså er lig med:[3]
Udtrykket kommer fra Coulombs lov, så der skal blot ganges en faktor på for at generalisere til andre atomkerner.[4]
Eksterne henvisninger
Kildehenvisninger
Wikiwand - on
Seamless Wikipedia browsing. On steroids.