Trichlortriazin (též kyanurylchlorid, trichlorkyan, kyanurchlorid či cyanurchlorid; systematický název 2,4,6-trichlor-1,3,5-triazin) je anorganická sloučenina se vzorcem (NCCl)3. Tato bezbarvá tuhá látka je chlorovaným derivátem 1,3,5-triazinu. Jedná se o trimer chlorkyanu.[2] Je hlavním prekurzorem populárního, avšak kontroverzního herbicidu atrazinu.
| Trichlortriazin | |
|---|---|
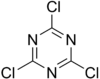 Strukturní vzorec trichlortriazinu | |
 Model molekuly trichlortriazinu | |
| Obecné | |
| Systematický název | 2,4,6-trichlor-1,3,5-triazin |
| Ostatní názvy | kyanurylchlorid, trichlorkyan, kyanurchlorid, cyanurchlorid |
| Anglický název | Cyanuric chloride |
| Německý název | Cyanurchlorid |
| Sumární vzorec | C3Cl3N3 |
| Vzhled | bílý prášek |
| Identifikace | |
| Registrační číslo CAS | 108-77-0 |
| EC-no (EINECS/ELINCS/NLP) | 203-614-9 |
| PubChem | 7954 |
| SMILES | Clc1nc(Cl)nc(Cl)n1 |
| Číslo RTECS | XZ1400000 |
| Vlastnosti | |
| Molární hmotnost | 184,41 g/mol |
| Teplota tání | 154 °C |
| Teplota varu | 192 °C |
| Hustota | 1,32 6 g/cm3 |
| Rozpustnost ve vodě | hydrolyzuje |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
Některá data mohou pocházet z datové položky. | |
Výroba
Trichlortriazin se vyrábí ve dvou krocích z kyanovodíku přes meziprodukt chlorkyan, který se trimerizuje za zvýšené teploty na uhlíkovém katalyzátoru:
- HCN + Cl2 → ClCN + HCl
- 3 ClCN → (ClCN)3
Průmyslové použití
Odhaduje se, že 70 % trichlortriazinu připadá na použití pro výrobu triazinových pesticidů, zejména atrazinu. Takové reakce jsou založeny na snadné náhradě chloridů nukleofily, například aminy:
- (ClCN)3 + 2 RNH2 → (RNHCN)(ClCN)2 + RNH3+Cl−
Podobně lze vyrábět další triazinové herbicidy, například simazin, anilazin nebo cyromazin.[4]
Trichlortriazin se využívá také jako prekurzor pro barviva a zesíťovací činidla. Největší třída těchto barviv jsou sulfonované triazin-stilbenové optické zjasňovače (OBA) čili fluorescenční bělidla (FWA), často používané v pracích prostředcích a bílém papíře.[3] Triazinový kruh je začleněn také v mnoha reaktivních barvivech. I tato se vyrábějí substitucí chloru jiným radikálem, jako v reakci popsané výše.[4]
Organická syntéza
V jedné specializované aplikace se trichlortriazin využívá jako reagens při konverzi alkoholů a karboxylových kyselin na alkyl-, resp. acylchloridy:[5]
Využívá se i jako dehydratační činidlo a pro aktivaci karboxylových kyselin při redukci na alkoholy. Zahříváním s dimethylformamidem vzniká Goldovo reagens Me2NCH=NCH=NMe2+Cl−, které je víceúčelovým zdrojem pro aminoalkylace a prekurzorem heterocyklických sloučenin.[6][7]
Chloridová centra lze snadno nahradit aminy za vzniku melaminových derivátů, například v syntéze dendrimerů:[8][9]
Trichlortriazin se využívá i při syntéze experimentálního ligandu adenosinového receptoru.[10]:
Reference
Externí odkazy
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.






