chemická sloučenina From Wikipedia, the free encyclopedia
Hexakarbonyl molybdenu je chemická sloučenina se vzorcem Mo(CO)6. Jedná se, podobně jako u hexakabonylů chromu a wolframu, o těkavou, na vzduchu stálou, pevnou látku obsahující kov v oxidačním čísle 0.
| Hexakarbonyl molybdenu | |
|---|---|
 Strukturní vzorec | |
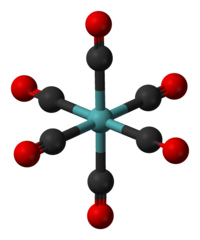 Model molekuly | |
| Obecné | |
| Systematický název | hexakarbonyl molybdenu |
| Funkční vzorec | Mo(CO)6 |
| Sumární vzorec | MoC6O6 |
| Vzhled | růžové krystaly |
| Identifikace | |
| Registrační číslo CAS | 13939-06-5 |
| EC-no (EINECS/ELINCS/NLP) | 237-713-3 |
| PubChem | 98885 |
| ChEBI | 30508 |
| SMILES | O=C=[Mo](=C=O)(=C=O)(=C=O)(=C=O)=C=O |
| InChI | InChI=1S/6CO.Mo/c6*1-2; |
| Vlastnosti | |
| Molární hmotnost | 264,02 g/mol |
| Teplota tání | 150 °C (423 K) |
| Teplota varu | 156 °C (429 K) |
| Hustota | 1,96 g/cm3 |
| Rozpustnost ve vodě | nerozpustný |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu a diethyletheru |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −989,1 kJ/mol |
| Standardní molární spalná entalpie ΔH°sp | −2123,4 kJ/mol |
| Bezpečnost | |
| H-věty | H300 H310 H315 H319 H330 H413 |
| P-věty | P261 P271 P280 P304+340+311 P405 P501 |
Některá data mohou pocházet z datové položky. | |
Mo(CO)6 má oktaedrickou geometrii vytvořenou šesti CO ligandy navázanými na atom Mo.
Mo(CO)6 se připravuje redukcí chloridů nebo oxidů molybdenu oxidem uhelnatým, díky jeho nízké ceně ale není nutná příprava v laboratoři.[1] Na vzduchu je stálý a v nepolárních organických rozpouštědlech jen málo rozpustný.
Mo(CO)6 byl nalezen na skládkách a v odpadních vodách, kde se vyskytují redukční anaerobní podmínky, napomáhající jeho tvorbě.[2]
Hexakarbonyl molybdenu je často používán ve výzkumu.[3] Jeden nebo více CO ligandů lze nahradit jinými a vytvořit tak další komplexy.[4] Mo(CO)6, [Mo(CO)3(MeCN)3] a obdobné sloučeniny se používají jako katalyzátory v organické syntéze, například při metatezích alkynů a Pausonových–Khandových reakcích.
Mo(CO)6 reaguje s 2,2′-bipyridinem za vzniku Mo(CO)4(bipy). Ultrafialovou fotolýzou roztoku Mo(CO)6 v tetrahydrofuranu vzniká Mo(CO)5(THF).
Tepelnou reakcí Mo(CO)6 s piperidinem vzniká komplex Mo(CO)4(piperidin)2. Piperidinové ligandy jsou zde nestálé, což umožňuje navázání jiných ligandů za mírných podmínek; například reakcí s trifenylfosfinem ve vroucím dichlormethanu (teplota varu kolem 40 °C) se vytváří cis-[Mo(CO)4(PPh3)2]. Tento cis- komplex se v toluenu izomerizuje na trans-[Mo(CO)4(PPh3)2].[5]
Mo(CO)6 lze také přeměnit na tris(acetonitril)ový komplex; ten se dá použít jako zdroj Mo(CO)3, kde například reakcí s allylchloridem vzniká [MoCl(allyl)(CO)2(MeCN)2], zatímco za přítomnosti KTp se tvoří anion [MoTp(CO)3]− a reakcí s cyklopentadienidem sodným [MoCp(CO)3]−. Tyto anionty reagují s řadou různých elektrofilů.[6] Podobným zdrojem Mo(CO)3 je trikarbonyl cykloheptatrienmolybdenu.
Hexakarbonyl molybdenu se používá při depozici indukované paprskem elektronů, protože se snadno odpařuje a následně paprskem elektronů rozkládá za uvolnění atomů molybdenu.[7]
Stejně jako ostatní karbonyly kovů je Mo(CO)6 nebezpečný jakožto těkavý zdroj kovu a oxidu uhelnatého.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.