Fluorid berylnatý
chemická sloučenina From Wikipedia, the free encyclopedia
Remove ads
Fluorid berylnatý je anorganická sloučenina s chemickým vzorcem BeF2. Tato bílá pevná látka je hlavním prekurzorem pro výrobu kovového beryllia. Strukturou se fluorid berylnatý podobá křemeni, ale fluorid berylnatý je dobře rozpustný ve vodě.
Remove ads
Remove ads
Vlastnosti
Fluorid berylnatý má výrazné optické vlastnosti. Ve formě fluoroberylátového skla má nejnižší index lomu pro pevnou látku při pokojové teplotě 1,275. Disperze fluoridu berylnatého je nejnižší pro pevnou látku a činí 0,0093 a nelineární koeficient je rovněž nejnižší a činí 2×10−14.
Struktura

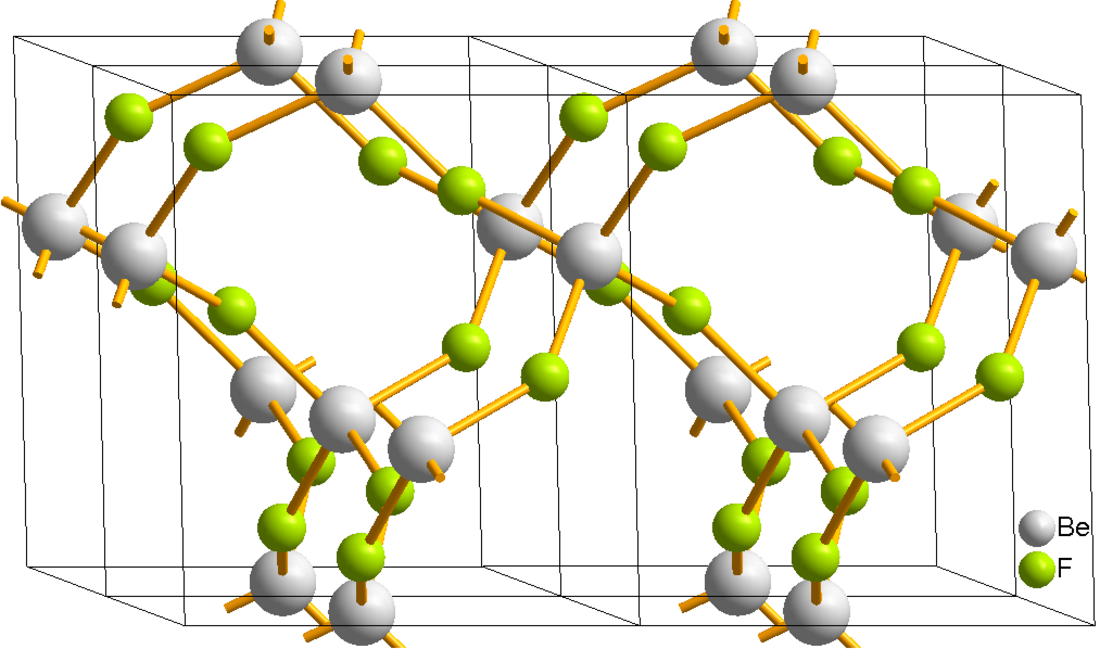
Struktura pevného fluoridu berylnatého se podobá struktuře cristobalitu. Ionty Be2+ jsou tetraedricky koordinované a fluoridy mají koordinační číslo dva.[1] Délka vazeb mezi fluorem a berylliem je přibližně 1,54 Å.[2] Analogicky k oxidu křemičitému může fluorid berylnatý také zaujímat řadu příbuzných struktur. Analogie existuje také mezi fluoridem berylnatým a fluoridem hlinitým: oba přijímají při mírné teplotě rozšířené struktury.
Plynný a kapalný fluorid berylnatý
Plynný fluorid berylnatý má lineární strukturu se vzdáleností Be-F 143 pm.[3] Fluorid berylnatý dosahuje tlaku par 10 Pa při 686 °C, 100 Pa při 767 °C, 1 kPa při 869 °C, 10 kPa při 999 °C a 100 kPa při 1172 °C.[4]
Molekuly kapalného fluoridu berylnatého mají kolísavou tetraedrickou strukturu. Hustota kapalného fluoridu berylnatého navíc v blízkosti bodu tuhnutí klesá, protože ionty Be2+ a F− se začínají vzájemně silněji koordinovat, což vede k rozšiřování dutin.[5]
Remove ads
Příprava
Při zpracování beryliových rud vzniká nečistý hydroxid berylnatý. Tento materiál reaguje s hydrogendifluoridem amonným za vzniku tetrafluoroberylnatanu amonného:
Be(OH)2 + 2 (NH4)HF2 → (NH4)2BeF4 + 2 H2O
Tetrafluoroberylnatan je čištěn srážením. Zahříváním přečištěného (NH4)2BeF4 vzniká fluorid berylnatý:
(NH4)2BeF4 → 2 NH3 + 2 HF + BeF2
Reaktivita iontů fluoridu berylnatého s fluoridy je obecně zcela analogická reakcím oxidu křemičitého s oxidy.[6]
Využití
Redukce fluoridu berylnatého při 1300 °C s hořčíkem v grafitovém kelímku představuje nejpraktičtější cestu k zisku kovového beryllia:[3]
BeF2 + Mg → Be + MgF2
Chlorid berylnatý není užitečným prekurzorem kvůli své těkavosti.
Fluorid berylnatý se využívá v biochemii, zejména v krystalografii proteinů, jako napodobenina fosfátu. ADP a fluorid berylnatý mají tedy tendenci se společně vázat na místa ATP a inhibovat působení proteinů, což umožňuje krystalizovat proteiny ve vázaném stavu.[7][8]
Fluorid berylnatý tvoří základní složku preferované směsi fluoridových solí používané v jaderných reaktorech s kapalným fluoridem. Fluorid berylnatý se obvykle mísí s fluoridem lithným, čímž vzniká základní rozpouštědlo (FLiBe), do kterého se zavádějí fluoridy uranu a thoria. Fluorid berylnatý je mimořádně chemicky stabilní a směsi LiF/BeF2 (FLiBe) mají nízké teploty tání (360–459 °C) a nejlepší vlastnosti ze všech kombinací fluoridových solí vhodných pro použití v reaktorech.
Remove ads
Bezpečnost
Sloučeniny beryllia jsou vysoce toxické. Zvýšená toxicita berylia v přítomnosti fluoridu byla zaznamenána již v roce 1949.[9] LD50 u myší je přibližně 100 mg/kg při požití a 1,8 mg/kg při injekci do žíly.
Odkazy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads