E1 reakce je označení typu eliminační reakce, kde E označuje eliminaci a číslice 1 ukazuje, že jde o monomolekulární reakci.
E1 reakce mají následující vlastnosti:
- Skládají se ze dvou kroků: ionizace a deprotonace.
- Při ionizaci zanikne vazba uhlík-halogen za vzniku karbokationtu. Tento karbokation je následně deprotonován.
- E1 mechanismem obvykle probíhají eliminace u terciárních alkylhalogenidů, může se však objevit i u některých sekundárních alkylhalogenidů.
- Rychlost reakce je ovlivňována pouze koncentrací alkylhalogenidu, protože je zde nejpomalejším krokem, tedy tím, který určuje rychlost reakce, tvorba karbokationtu a reakce je tak prvního řádu. Není závislá na síle a koncentraci zásady.
- E1 reakce probíhají společně s SN1 reakcemi, protože mají společný karbokationtový meziprodukt.
- Sekundární deuteriový izotopový efekt je mírně větší než 1, obvykle 1 až 1,5.
- Odstupující skupiny nemusí být navzájem v antiperiplanární poloze.

Pouze produkt A vznikl antiperiplanární eliminací. Tvorba produktu B naznačuje synperiplanární reakci a tedy E1 mechanismus.[1]
Společně s monomolekulárními eliminacemi probíhají také karbokationtové přesmyky.
Na následujícím obrázku je znázorněna reakce terc-butylbromidu s ethoxidem draselným v ethanolu:
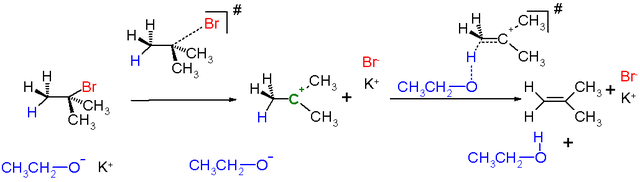
Eliminace vysoce substituovaných alkylhalogenidů probíhají E1 mechanismem z těchto důvodů:
- Tyto alkylhalogenidy mají objemné molekuly, čímž zabírají místo potřebné pro E2 reakci.
- Karbokationty od nich odvozené jsou stabilnější než primární karbokationty, tato stabilita dává dostatek času k E1 reakci.
- Pokud společně probíhají E1 a SN1 reakce, tak lze rovnováhu posunout ve prospěch eliminace zvýšením teploty.
Reference
Wikiwand - on
Seamless Wikipedia browsing. On steroids.