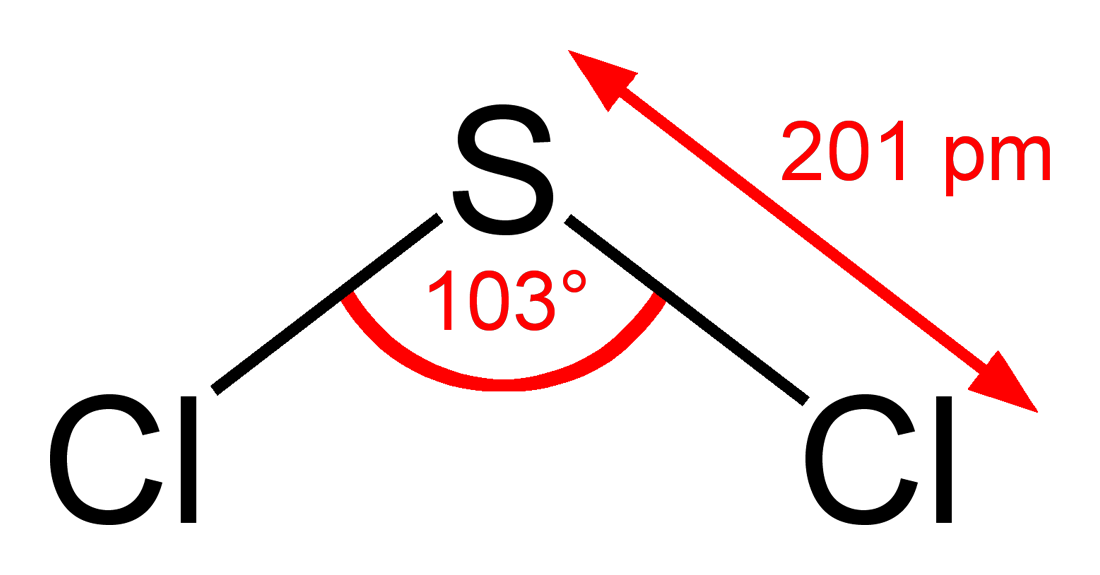
Chlorid sirnatý je anorganická sloučenina se vzorcem SCl2. Tato třešňově červená kapalina je nejjednodušším a jedním z nejobvyklejších chloridů síry.
| Chlorid sirnatý | |
|---|---|
 Strukturní vzorec | |
 Kuličkovo–tyčinkový model molekuly | |
 Kalotový model molekuly | |
| Obecné | |
| Systematický název | Chlorid sirnatý |
| Anglický název | Sulfur dichloride Sulfur(II) chloride Dichlorosulfane Sulpur chloride |
| Německý název | Schwefeldichlorid |
| Sumární vzorec | SCl2 |
| Vzhled | Červená kapalina s pronikavým zápachem |
| Identifikace | |
| Registrační číslo CAS | 10545-99-0 |
| EC-no (EINECS/ELINCS/NLP) | 234-129-0 |
| UN kód | 1828 |
| Číslo RTECS | WS4500000 |
| Vlastnosti | |
| Molární hmotnost | 102,97 g/mol |
| Teplota tání | −121,0 °C |
| Teplota varu | 59 °C (rozklad) |
| Hustota | 1,621 g/cm3 |
| Index lomu | 1,557 0 |
| Rozpustnost ve vodě | hydrolyzuje |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R14, R34, R37, R50 |
| S-věty | S1/2, S26, S45, S61 |
| NFPA 704 |  1
3
1
|
| Teplota vznícení | 234 °C |
Některá data mohou pocházet z datové položky. | |
Příprava a vlastnosti
Chlorid sirnatý se připravuje reakcí chloru s elementární sírou nebo chloridem sirným. Jde o několikakrokový proces, který lze popsat rovnicemi:
- S8 + 4 Cl2 → 4 S2Cl2; ΔH = −58.2 kJ/mol
- S2Cl2 + Cl2 ⇌ 2 SCl2; ΔH = −40.6 kJ/mol
Reakce
Předchozí uvedená reakce je vratná a chlorid sirnatý se za pokojové teploty pomalu rozpadá na chlorid sirný a plynný chlor. Starší vzorky tak mohou být kontaminovány. Čistý chlorid sirnatý může být znova získán refluxováním s nadbytkem síry a následnou destilací.
Chlorid sirnatý při kontaktu s vodou rapidně hydrolyzuje na plynný chlorovodík, síru a oxid siřičitý.
- 4 SCl2 + 2 H2O → 4 HCl + 3 S + SO2
Použití
SCl2 se používá jako prekurzor organosírových sloučenin.[2]
Reaguje s alkeny za vzniku chlorsubstituovaných thioetherů, například s 1,5–cyklooktadienem za vzniku dicyklického thioetheru a s ethylenem za vzniku yperitu (S(CH2CH2Cl)2).[3]
Chlorid sirnatý je také prekurzorem několika anorganických sloučenin síry. Reakcí s fluoridy vzniká SF4.
Reakcí s amoniakem vznikají nitridy síry. Reakcí se sulfanem vznikají "nižší" sulfany jako H2S3.
Podobné sloučeniny
- Dichlorid disirnatý
- Chlorid thionylu
- Chlorid sulfurylu
- Fluorid siřičitý
- Fluorid sírový
- Dibromid disirnatý
Reference
Externí odkazy
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.