Acylchloridy jsou organické sloučeniny s molekulami obsahujícími skupinu -COCl; jedná se o reaktivní funkční deriváty karboxylových kyselin. Acylchloridy patří mezi acylhalogenidy.
Pokud je acyl hlavní skupinou, tak se acylchloridy pojmenovávají podle názvu tohoto acylu, ke kterému se přidá označení -chlorid, například:
Pokud acyl není hlavní skupinou, tak se používá předpona -chlorkarbonyl, například:
- kyselina (chlorkarbonyl)octová ClOCCH2COOH
Jelikož u acylchloridů nedochází k tvorbě vodíkových vazeb, tak mají tyto látky nižší teploty varu a tání než odpovídající karboxylové kyseliny; teplota varu kyseliny octové je 118 °C, zatímco acetylchlorid vře již při 51 °C.
Podobně jako většina karbonylových sloučenin mají acylchloridy v infračervených spektrech výrazný absorpční pás kolem hodnoty vlnočtu 1750 cm−1.
Nejjednodušším stabilním acylchloridem je acetylchlorid (systematickým názvem ethanoylchlorid); formylchlorid (methanoylchlorid) je za běžných podmínek nestabilní, lze jej však připravit za teplot pod -60 °C.[1][2]
V průmyslu
Průmyslově se acylchloridy vyrábějí reakcí acetanhydridu s chlorovodíkem. U benzoylchloridu se používá částečná hydrolýza benzotrichloridu:[3]
- C6H5CCl3 + H2O → C6H5C(O)Cl + 2 HCl
V laboratořích
Laboratorně se acylchloridy, podobně jako chlorované uhlovodíky, získávají nahrazením hydroxylových skupin atomy chloru: karboxylová kyselina reaguje s chloridem thionylu (SOCl2),[4] chloridem fosforitým (PCl3)[5] nebo chloridem fosforečným (PCl5):[6][7]
- RCOOH + SOCl2 → RCOCl + SO2 + HCl
- 3 RCOOH + PCl3 → 3 RCOCl + H3PO3
- RCOOH + PCl5 → RCOCl + POCl3 + HCl
Reakci s chloridem thionylu je možné katalyzovat dimethylformamidem.[8] Při tomto postupu vznikají oxid siřičitý a chlorovodík, což jsou plyny, které se z reakční směsi odstraňují a tím dochází k posunu reakční rovnováhy ve prospěch produktů. Přebytek thionylchloridu, jehož teplota varu činí 74,6 °C, lze taktéž snadno odstranit.[7] Mechanismy reakcí s thionylchloridem a chloridem fosforečným jsou podobné; níže je zobrazen mechanismus při použití thionylchloridu:[8]
Při jiné metodě se používá oxalylchlorid:
- RCOOH + ClCOCOCl → RCOCl + CO + CO2 + HCl
Katalyzátorem je zde dimethylformamid, který na začátku reaguje s oxalylchloridem za vzniku iminiového meziproduktu,
který poté reaguje s karboxylovou kyselinou, přičemž dochází k odštěpení oxidu a obnovení katalyzátoru.
Jsou známy i takové postupy přípravy acylchloridů, při kterých nevzniká HCl, jako jsou například Appelova reakce[9]
- RCOOH + Ph3P + CCl4 → RCOCl + Ph3PO + HCCl3
a příprava za použití trichlortriazinu:[10]
Nukleofilní reakce
Acylchloridy jsou mnohem reaktivnější než karboxylové kyseliny; chloridový aniont je velmi dobrou odcházející skupinou, zatímco hydroxid tuto vlastnost za obvyklých podmínek nemá, a tak mohou s karbonylovou skupinou reagovat i slabé nukleofily; příkladem může být reakce s vodou za vzniku příslušné karboxylové kyseliny:
- RCOCl + H2O → RCO2H + HCl
Acylchloridy lze použít na přípravu derivátů karboxylových kyselin jako jsou anhydridy, estery a amidy, reakcemi se solemi příslušných kyselin, alkoholy či aminy. Za přítomnosti zásady, například vodného roztoku hydroxidu sodného nebo pyridinu,[7] případně přebytku aminu (při přípravě amidů),[8] je potřeba odstraňovat vznikající chlorovodík a reakce musí být katalyzována. I když lze estery či amidy často získat reakcí karboxylové kyseliny s alkoholem nebo aminem, tak jsou tyto reakce vratné, což vede k nízké výtěžnosti; příprava těchto látek z acylchloridů je rychlá a nevratná a tak se často upřednostňuje před přímou reakcí s karboxylovou kyselinou.[7]
Při reakcích acylchloridů s Grignardovými činidly se obvykle nejprve tvoří ketony a následně terciární alkoholy; výjimku představují reakce s některými organickými sloučeninami kadmia, při nichž se proces zastaví u ketonu. Nukleofilní reakce s Gilmanovými činidly (organickými sloučeninami obsahujícími lithium a měď) také, díky nižší reaktivitě těchto látek, poskytují ketony.[7] Chloridy aromatických kyselin jsou obecně méně reaktivní než chloridy alkylových kyselin a často jsou tak potřeba tvrdší podmínky.
Acylchloridy je možné zredukovat silnými donory hydridů, jako je hydrid lithno-hlinitý, za tvorby primárních alkoholů. Tri-terc-butoxyhydrid lithnohlinitý přeměňuje acylchloridy na aldehydy.[11]
Elektrofilní reakce
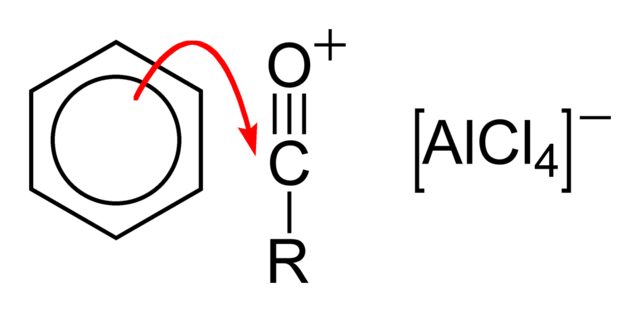
Acylchloridy se, společně s Lewisovými kyselinami, jako například chloridem železitým a chloridem hlinitým, účastní Friedelových–Craftsových acylací, při nichž vznikají arylketony.[5][7]
V prvním kroku proběhne disociace chloridu, kterou vyvolá Lewisova kyselina:
Poté následuje nukleofilní atak arenu na acylovou skupinu:
Nakonec nastane spojení chloridového aniontu s uvolněným protonem za vzniku HCl a regenerace katalyzátoru (zde AlCl3):
Vzhledem ke značné reaktivitě těchto látek je při skladování acylchloridů nutné opatrné zacházení. Mají dráždivé účinky na oči, jelikož reagují s vodou za vzniku chlorovodíku a organických kyselin.
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.