Organická fotochemie je obor organické chemie a fotochemie zkoumající organické reakce spouštěné působením světla;[1][2] tyto reakce často vyvolává pohlcování ultrafialového záření organickými molekulami. V organické fotochemii se nejdříve využívalo viditelné světlo, zatímco později převládlo používání ultrafialových lamp. Organické fotochemické reakce se používají na jednoduché vytváření složitých organických molekul.
První případy organofotochemických reakcí, které spočívaly v tvorbě sraženin nebo změnách barvy při vystavení vzorků slunečnímu světlu, nebyly často zachyceny. Prvním popsanou organofotochemickou reakcí byla přeměna santoninu na žlutou sloučeninu pomocí slunečního světla:[3]

Jedním z prvních příkladů fotochemické tvorby sraženiny byla fotodimerizace antracenu.[4] Podobně se podařilo dimerizovat kyselinu skořicovou na kyselinu truxilovou. Nyní je známo mnoho dalších fotodimerů, například pyrimidinu, thiofosgenu a diamantanu.
V roce 1956 byla provedena reakce, při které proběhla fotolýza nitroskupiny v poloze meta namísto obvyklé aktivace v polohách ortho a para.[5]

Pokrok v organické fotochemii přinesla Woodwardova–Hoffmannova pravidla.[6][7] Tato pravidla pomohla vysvětlit výsledek fotochemicky řízené elektrocyklického uzavírání kruhu hexa-2,4-dienu, které probíhá disrotačně.

Organické reakce vyhovující těmto pravidlům se označují jako symetricky povolené. Reakce probíhající opačně jsou symetricky zakázané a buď vyžadují mnohem více energie, nebo vůbec neprobíhají.
Organické fotochemické reakce se vysvětlují pomocí excitovaných stavů.[8][9]
Podobně jako u struktury byl zkoumán také vliv násobnosti spinových stavů - zda jde o singlety nebo triplety - na reaktivitu. Triplety mívají delší životnosti a nižší energie než singlety o stejné konfiguraci. Triplety mohou vznikat z vytvořených singletů nebo interakcemi s triplety o vyšších energiích.
K běžným organickým fotochemickým reakcím patří: Norrishovy reakce (dělené na typy I a II), racemizace opticky aktivních bifenylů, cyklohexadienonové přesmyky (mohou být typu A nebo B), di-pí-methanové přesmyky, přesmyky bicyklo[3.1.0]hexanonů na fenoly, fotochemické elektrocyklické procesy, přesmyky epoxyketonů na beta-diketony, otevírání kruhu u cyklopropylketonů, heterolýzy 3,5-dimethoxylbenzylových sloučenin, a fotochemické cyklizace dienů.

Reaktanty fotochemických reakcí mohou být plynné i kapalné.[10] Zpravidla se reagující látky musí dostat do blízkosti zdroje světla, aby bylo dosaženo nejvyšší možné světelné účinnosti. Reakční směs tak může být ozářena buď přímo, nebo ze strany reaktoru.[11]
Nevýhodou fotochemických reakcí je nízká účinnost přeměny elektrické energie na energii záření o potřebné vlnové délce. Zdroj záření vydává také velké množství tepla, což způsobuje nutnost chlazení. Většina zdrojů vyzařuje polychromatické záření, potřeba je však monochromatické.[12] Tyto nevýhody jsou vyvažovány vysokým kvantovým výtěžkem.
Tyto reakce je výhodné provádět za nízkých teplot, čímž se omezí vedlejší reakce (a zlepší selektivita) a tím i výtěžnost (protože se sníží míra vypařování plynných reaktantů z roztoku).
Výchozí látky se před reakcí někdy ochladí natolik, že teplo uvolněné reakcí je absorbováno, aniž by bylo nutné reakční směs dále chladit. U plynných nebo nízkovroucích reaktantů je potřebný přetlak.
Vzhledem k velkému počtu možných výchozích látek je popsáno i mnoho různých fotochemických reakcí.[13][14]
[2+2] cykloadice
Alkeny se mohou dimerizovat působením ultrafialového záření.[15]
Přesmyk 4,4-difenylcyklohexadienonu
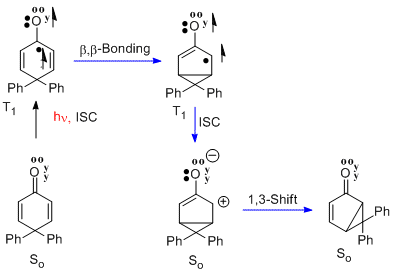
Obdobou přeměny santoninu na lumisantonin je přesmyk 4,4-difenylcyklohexadienonu.[9] V tomto případě n-π* tripletový excitovaný stav prochází stejnou beta-beta reakcí. Následně se vytvoří singletový zwitterion v základním stavu. Posledním krokem je přesmyk, kterým vzniká bicyklická sloučenina. Reakce patří mezi cyklohexadienonové přesmyky typu A.
4,4-difenylcyklohexenon
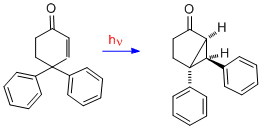
Přesmyk 4,4-difenylcyklohexenonu se liší od předchozích tím, že jsou k přesmykům typu A potřeba dvě dvojné vazby. Dvojná vazba na jedné z fenylových skupin, původně na C-4, se přesouvá na C-3 (tedy beta uhlík).[16]
Pokud je na jeden z arylů navázána para-kyano nebo para-methoxyskupina, tak se tento aryl přesouvá přednostně.[17]Zkoumáním fenoniových sloučenin, u kterých se aryl začal přesouvat na beta-uhlík, bylo zjištěno, že za přítomnosti substituentu v poloze para zvyšuje míru delokalizace elektronů a tato reakční dráha je tak více stabilizovaná.

n-π* reaktivita
Dalším druhem fotochemické reakce je di-pí-methanový přesmyk;[18] patří sem například přesmyky 1,1,5,5-tetrafenyl-3,3-dimethyl-penta-1,4-dienu[19] a barrelenu na semibullvalen.[20]
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.