Sòlid amorf
estat sòlid de la matèria en el qual les partícules no tenen una estructura ordenada From Wikipedia, the free encyclopedia
Remove ads
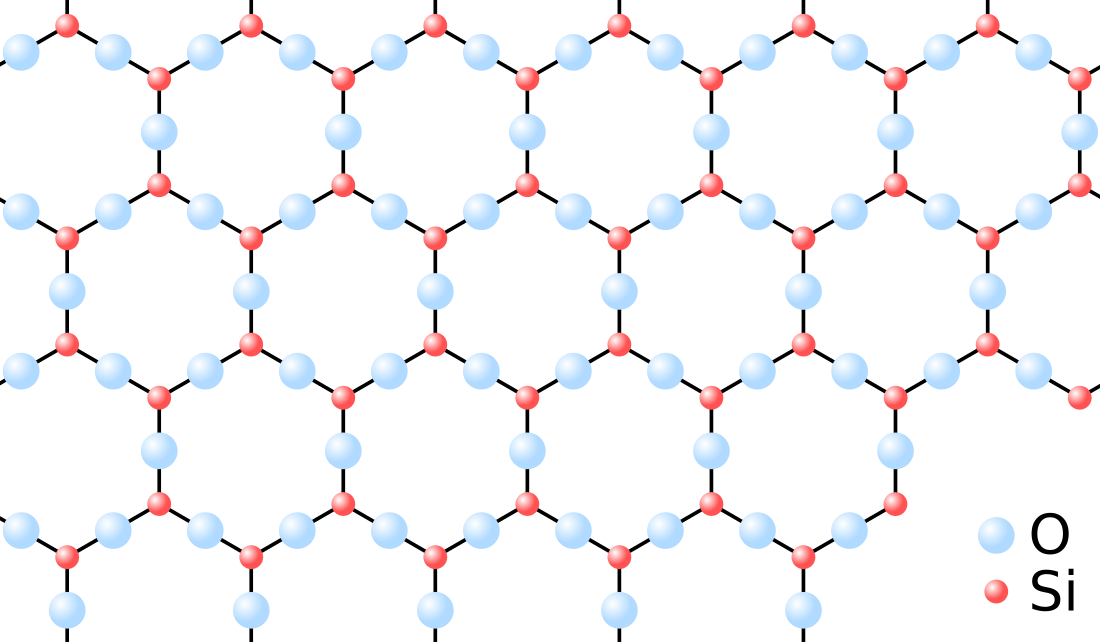
El sòlid amorf és un estat sòlid de la matèria, en el qual les partícules que conformen el sòlid no tenen una estructura ordenada. Aquests tipus de sòlids no tenen formes i cares ben definides. Aquesta classificació contrasta amb la dels sòlids cristallins, els àtoms dels quals estan disposats de manera regular i ordenada formant xarxes cristal·lines.[1][2][3][4][5]


Molts sòlids amorfs són mescles de molècules que no es poden apilar bé. Gairebé tots els altres es componen de molècules grosses i complexes. Entre els sòlids amorfs més coneguts hi ha el vidre i els plàstics.
Un mateix compost, segons el procés de solidificació, pot formar una xarxa cristallina o un sòlid amorf. Per exemple segons la disposició espacial de les molècules de sílice (SiO₂), es pot obtenir una estructura cristallina (el quars) o un sòlid amorf (el vidre). Les molècules dels sòlids amorfs estan distribuïdes a l'atzar i les propietats físiques del sòlid són idèntiques en totes les direccions (isotropia).
Les formes amorfes tenen una temperatura característica en la qual les seves propietats experimenten canvis importants. Aquesta temperatura és coneguda com a temperatura de transició vítria (Tg). La temperatura de transició a vidre d'un material amorf pot reduir-se afegint molècules petites, anomenadess "plastificadors", que s'adapten entre les molècules vítries a mobilitat més gran.
Una conseqüència directa de la disposició irregular de les partícules en un sòlid amorf, és la diferència d'intensitat que prenen les forces intermoleculars entre elles, d'aquí que la fusió s'arribi a temperatures diferents, segons la proporció de les diferents partícules que formen la mostra. Per això un sòlid amorf no té un punt de fusió definit, sinó en un interval de temperatura. Quan s'escalfa un sòlid amorf, la substància no manifeste un punt de fusió, encara que s'estova progressivament augmentant la seva tendència a deformar-se. En contrast, la temperatura de fusió d'un sòlid cristal·lí està ben definida.
Respecte a les seves propietats elàstiques, els sòlids amorfs tenen les propietats dels cristalls.
Pel que fa al magnetisme, els metalls amorfs presenten les propietats magnètiques més notables, es comporten com materials ferromagnètics.
Remove ads
Obtenció
Els sòlids amorfs es poden formar, en condicions naturals, si creixen en condicions on no hi ha prou mobilitat dels àtoms. L'any 1969, David Turnbull va escriure que "probablement tots els materials poden, si es refreden amb prou rapidesa i llunyania de la temperatura crítica, ser transformats en sòlids amorfs".[6]
Artificialment, hi ha diversos mètodes d'obtenció de sòlids amorfs. El mètode més antic i més emprat és el de la fosa temperada, del qual es coneixen algunes varietats:
Bloc congelat
Aquesta tècnica necessita un alt interval de temperatures per al refredament i formar un aliatge metàl·lic. Un raig de metall fos és propulsat contra la superfície d'un cilindre de coure, el qual es troba en ràpida rotació, la qual cosa obliga el líquid a refredar-se (a temperatura ambient o menor). Dins la tècnica del bloc congelat, es distingeix entre splat-cooling i el temperat giratori d'extracció.
Temperat amb líquid
Aquesta tècnica pot ser utilitzada per al refredament de líquids, utilitzant banys de gel als quals s'introdueixen petites quantitats de fosa; permet refredar amb rangs de velocitat alts.
Temperat a l'aire
Aquesta tècnica pot ser utilitzada per a materials amb tendència a la formació de sòlids amorfs. Es pot obtenir la fosa amb refredament lent, cosa que s'aconsegueix apagant el forn. Sòlids amorfs obtinguts mitjançant aquest mètode són SiO2, As2S3 i poliestirè.
Condensació del vapor
Aquesta tècnica comença quan el vapor format en una cambra de buit, per l'evaporació del material, xoca amb una superfície freda, obtenint-se una substància amorfa.
Remove ads
Aplicacions
Per les seves propietats mecàniques hi ha un gran nombre de sòlids amorfs que es fan servir com materials per a la indústria i la construcció. Els òxids amorfs es fan servir com vidre de finestres. Alguns polímers són plàstics. Semiconductors en les memòries dels ordinadors i en cèl·lules solars, etc.
Els òxids amorfs, gràcies a la seva transparència, solidesa i facilitat per donar-li forma en làmines grans, es fan servir profusament com a vidre de finestra. Certs polímers orgànics, en virtut de la seva resistència, pes lleuger i fàcil processament, s'empren com a materials estructurals (plàstics). Hi ha semiconductors amorfs que es fan servir en les memòries d'ordinador i en cèl·lules solars gràcies a les seves propietats òptiques fotovoltaiques i en la facilitat per crear pel·lícules primes de gran superfície. Els metalls amorfs s'empren en nuclis de transformador gràcies al seu ferromagnetisme, baixes pèrdues i la possibilitat de formar cintes llargues. El calcogenur amorf s'empra en xerografia en virtut de la seva fotoconductivitat i la possibilitat de formar pel·lícules de gran àrea.
Remove ads
Casos particulars
Les definicions i explicacions científiques poden ser difícils d'entendre per part de persones no especialitzades. Uns quants exemples pràctics de sòlids amorfs, familiars o exòtics, haurien de permetre una comprensió intuitiva del tema.
 |
VidresEls vidres i materials vitris són un dels exemples típics de sòlids amorfs.[7] La figura mostra material de laboratori fabricat de vidre de borosilicat.[8] Encara que popularment s'anomena vidre i vidre un mateix material, hi ha una diferència essencial entre tots dos. El vidre fa referència a un estat d'ordenació de la matèria que es troba a la natura en diferents formes (per exemple, quars o vidre de roca). El vidre, però, és el resultat de la fusió de certs ingredients (sílice, sosa i calç). Hi ha, però, vidres creats per la natura, com l'obsidiana que es forma per la calor generada a l'interior dels volcans. S'anomena erròniament vidre al vidre de plom o vidre òptic, ja que la seva transparència imita el cristall de roca natural; aquesta imitació havia estat sempre la meta principal dels vidriers. La transició vitri-líquid, o transició vítria, és la transició gradual i reversible en materials amorfs (o en regions amorfes dins de materials semicristal·lins), des d'un estat "vitri" dur i relativament trencadís a un estat viscós o gomós a mesura que augmenta la temperatura.[9] Un sòlid amorf amb una transició vítria s'anomena vidre. La transició vítria es considera un dels problemes més importants i no resolts de la física. La transició inversa, que s'aconsegueix en refredar un líquid viscós a l'estat de vidre, s'anomena vitrificació. |
 |
BasaltLes roques de basalt són considerades amorfes (sòlids amorfs) per alguns autors.[10][11] La figura mostra una estela babilònica de basalt.[12] |
 |
PlàsticsLa figura mostra un recipient de polipropilè. La majoria de peces de plàstic habituals són sòlids amorfs. Els polímers són compostos macromoleculars de cadena llarga, constituïts principalment per carboni (C), hidrogen (H) i oxigen (O), encara que de vegades poden presentar F, N, P i S. unió de monòmers mitjançant la unió d'una reacció química anomenada polimerització. La polimerització pot dur-se a terme de forma natural, com passa amb les proteïnes, o bé de forma artificial, obtenint-se materials plàstics. Aquestes macromolècules poden presentar moltes configuracions i conformacions. La configuració fa referència a diferències estructurals de curt abast i no es pot modificar de forma reversible. Els polímers tenen estructures poc compactes a causa de l'enrotllament de les cadenes i de la presència de grups atòmics laterals. Tot allò que contribueix a un pobre empaquetament, afavoreix la formació d'una estructura forma, per exemple, cadenes moleculars molt llargues i ramificades, distribució a l'atzar de grups laterals grans al llarg de les cadenes, cadenes copolimèriques (formades per combinació de dos o més monòmers), així com la presència d'additius plastificants que separen les cadenes les unes de les altres i s'afegeixen als plàstics per millorar propietats. Els polímers, els monòmers dels quals són certament senzills, desenvolupen cert grau d'ordenament segons com s'han refredat, però no tot el material cristal·litza. Exemple de materials plàstics parcialment cristal·lins són el polietilè, polipropilè isotàctic, niló, i el politereftalat d'etilè (PET). Els materials canvien les seves propietats mecàniques segons es trobin per sobre o per sota de la temperatura d'estovament. Per sobre, es deformen fàcilment en passar d'una conformació a una altra, mentre que per sota estan fixes. Al material amorf, les cadenes estan més separades que a l'estructura laminar. Això es reflecteix en una disminució de la densitat. Segons les seves propietats, es distingeixen diversos tipus de polímers:
|
 |
Jade |
Remove ads
Sòlids de macroestructura amorfa
Des d'un punt de vista general, i sense tenir en compte les propietats òptiques ni el punt de fusió, hi ha una munió de sòlids que tenen una estructura amorfa i unes qualitats de resistència prou interessants. Principalment des del punt de vista de la seva resistència estructural.
 |
TovaEn les construccions de toves, cada tova presenta una estructura amorfa. Les propietats mecàniques són sensiblement isòtropes. Les parets de tàpia tenen una estructura interna semblant. |
Remove ads
Caracterització de sòlids amorfs
A causa de la manca d'ordre de llarg abast, les tècniques cristal·logràfiques estàndard solen ser inadequades per determinar l'estructura dels sòlids amorfs.[13] S'han utilitzat diverses tècniques basades en electrons, raigs X i computació per caracteritzar materials amorfs. L'anàlisi multimodal és molt comú per a materials amorfs.
Entre els mètodes que es poden citar hi ha:
- Difracció de raigs X i neutrons
- Espectroscòpia de raigs X
- Tomografia electrònica atòmica
- Microscopia electrònica de fluctuació
- Tècniques computacionals
Remove ads
Referències
Bibliografia
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads