La química inorgànica és la branca de la química que s'ocupa de l'estudi del comportament dels compostos inorgànics, és a dir, els que no contenen carboni (en contraposició als compostos orgànics, que sí que en contenen). De fet, la distinció entre compostos orgànics i inorgànics és difosa i força arbitrària: d'una banda, hi ha compostos amb carboni que es consideren inorgànics, com els carburs, els carbonats, el grafit o el diamant; de l'altra, molts compostos formats bàsicament per àtoms de carboni també contenen metalls de transició. Tradicionalment estudiats per la química inorgànica, aquests compostos són estudiats per la química organometàl·lica, una disciplina que s'encavalca entre les dues branques.

A: el diborà presenta uns enllaços poc usuals
B: el clorur de cesi té una estructura cristal·lina arquetípica
C: el Fp₂ és un organometàl·lic complex
D: els usos de la silicona van des dels implants mamaris fins al Silly Putty
E: el descobridor del catalitzador de Grubbs va guanyar el Premi Nobel de Química de 2005
F: la zeolita té molts usos com a sedàs molecular
G: l'acetat de coure (II) sorprengué els químics teòric amb el seu dimagnetisme
Les àrees d'estudi en química inorgànica són la química organometàl·lica, la química d'agregats i la química bioinorgànica.
Molts compostos inorgànics són compostos iònics que consisteixen en cations i anions units per un enllaç iònic. Alguns exemples de sals (que són compostos iònics) són el clorur de magnesi (MgCl₂), que consisteix en cations magnesi, Mg2+, i anions clorur, Cl−), o l'òxid de sodi (Na₂O), que consisteix en cations de sodi Na+ i anions òxid O2−. En qualsevol sal, la proporció dels ions és tal que la càrrega elèctrica es neutralitza, de tal manera que el conjunt de l'element sigui neutral. Els ions venen descrits pel seu estat d'oxidació i la seva facilitat de formació es pot inferir del potencial d'ionització (pels cations) o per l'afinitat electrònica dels elements pare (pels anions).

2O
Algunes classes importants de sals inorgàniques són els òxids, els carbonats, els sulfats i els halurs. Molts compostos inorgànics estan caracteritzats per tenir un elevant punt de fusió. Les sals inorgàniques són normalment pobres conductores elèctriques en estat sòlid. Una altra característica important és la seva solubilitat en aigua i facilitat de cristal·lització. Mentre que algunes sals (per exemple el clorur de sodi) són molt solubles en aigua, d'altres (per exemple el diòxid de silici no ho són.
La reacció inorgànica més simple és la metàtesi, en la qual després de mesclar dues sals els ions són intercanviats sense un canvi de l'estat d'oxidació. En les reaccions redox, d'altra banda, l'oxidant redueix el seu estat d'oxidació i el reductor l'incrementa. El resultat net és un intercanvi d'electrons. L'intercanvi d'electrons pot també tenir lloc indirectament, com per exemple en bateries, la qual cosa és un concepte clau de l'electroquímica. Quan un reactiu conté àtoms d'hidrogen, una reacció pot tenir lloc intercanviant protons en una reacció àcid-base.
Els compostos inorgànics es troben a la natura en forma de minerals. El sòl pot contenir sulfur de ferro en forma de pirita o sulfat de calci en forma de guix. Els compostos inorgànics també funcionen com biomolècules amb diferents tasques: com electròlits (clorur de sodi), per emmagatzematge d'energia (trifosfat d'adenosina o ATP) i per a la construcció (el polifosfat dorsal en l'ADN).
El primer compost inorgànic important creat per l'ésser humà fou el nitrat d'amoni, que serveix per a la fertilització del sòl mitjançant el procés Haber-Bosch. Els compostos inorgànics se sintetitzen per a usar-los com a catalitzadors, tals com l'òxid de vanadi (V) i el clorur de titani (III), o també com a reactius en química orgànica, com l'hidrur de liti i alumini.
Les subdivisions de la química inorgànica són la química organometàl·lica, la química d'agregats i la química bioinorgànica. Aquest camps tenen molta activitat de recerca en química inorgànica en cerca de nous catalitzadors, superconductors i teràpies.

Química inorgànica industrial
La química inorgànica és una àrea de la ciència molt pràctica. Tradicionalment, l'escala econòmica d'una nació es mesurava segons la seva producció d'àcid sulfúric. Els 20 components químics inorgànics més fabricats al Canadà, la Xina, Europa, l'Índia, el Japó i els Estats Units, en dades de 2005, van ser els següents.[1] sulfat d'alumini, amoníac, nitrat d'amoni, sulfat d'amoni, negre de carbó, clorur, àcid hidroclòric, hidrogen, peròxid d'hidrogen, àcid nítric, nitrogen, oxigen, àcid fosfòric, carbonat de sodi, clorat de sodi, hidròxid de sodi, silicat de sodi, sulfat de sodi, àcid sulfúric i diòxid de titani.
Una altra aplicació pràctica de la química inorgànica industrial és la fabricació de fertilitzants.
La química inorgànica descriptiva se centra en la classificació dels compostos segons les seves propietats. Parcialment, la classificació se centra en la posició de l'element dins la taula periòdica de l'element més pesant (l'element amb un pes atòmic més alt) del compost, i parcialment agrupant els compostos segons les seves similituds estructurals. Quan s'estudien els compostos inorgànics sovint es troben parts de les diferents classes de química inorgànica (un compost organometàl·lic està que es caracteritza per la seva química de coordinació i pot mostrar propietats d'estat sòlid interessants).
A continuació es detallen diferents classificacions.
Compostos de coordinació

Els compostos de coordinació clàssics són els metalls de parells solitaris d'electrons que resideixen en els àtoms dels grups principals de lligands com H₂O, NH₃, Cl− i CN−. En els compostos de coordinació moderns gairebé tots els compostos orgànics i inorgànics es poden utilitzar com a lligands. El "metall" normalment és un metall dels grups 3-13, així com els translantanoides i els transactinoides, però des d'una certa perspectiva tots els compostos químics es poden descriure com a complexes de coordinació.
L'estereoquímica dels complexos de coordinació pot ser molt rica, tal com es pot veure en la separació de Werner de dos enantiòmers de [Co((OH)₂Co(NH₃)₄)₃]6+, demostració que la quiralitat no és inherent als compostos orgànics. Un tema tòpic dins d'aquesta especialització és la coordinació química supramolecular.[2]
Compostos dels grups principals

Aquestes espècies contenen elements dels grups 1, 2 i 13-18 (excloent-ne l'hidrogen) de la taula periòdica. A causa de la seva (sovint) similar reactivitat, els elements del grup 3 (Sc, Y i La) i del grup 12 (Zn, Cd i Hg) també s'hi solen incloure.[3]
Els compostos dels grups principals s'han conegut des dels començaments de la química, com per exemple el sofre elemental i el sofre blanc destil·lable. Els experiments sobre oxigen (O₂) per Lavoisier i Priestley no tan sols van identificar un important gas diatòmic, sinó que també van obrir la porta per a descriure compostos i reaccions segons les ràtios etequiomètriques. La descoberta de la síntesi pràctica de l'amoníac usant catalitzadors de ferro per Carl Bosch i Fritz Haber a les primeries del segle xx van impactar profundament la societat, demostrant la importància de la síntesi química inorgànica.
Alguns compostos de grups principals típics són SiO₂, SnCl₄ i N₂O. Molts compostos de grups principals també es poden classificar com "organometàl·lics", ja que contenen grups orgànics (per exemple, B(CH₃)₃). Els compostos de grups principals també es troben a la natura, com per exemple el fosfat a l'ADN, per la qual cosa també es poden classificar com a bioinorgànics. A la inversa, els compostos orgànics que manquen de (molts) lligands d'hidrogen es poden classificar com "inorgànics", tals com els ful·lerens, els nanotubs de carboni i els òxids de carboni binaris.
Compostos de metalls de transició
Els compostos que contenen metalls dels grups de l'1 a l'11 són considerats compostos de metalls de transició. Els compostos amb un metall dels grups 3 o 12 també se solen incorporar en aquest grup, però també sovint es classifiquen com a compostos de grups principals.
Els compostos de metalls de transició mostren una rica química de coordinació que varia del tetraedre pel titani (per exemple TiCl₄) fins al pla quadrat per alguns complexos de níquel i fins a l'octaedre pels complexos de coordinació de cobalt. També hi ha alguns compostos biològics de metalls de transició molt importants, com el ferro en l'hemoglobina.
- Exemples: pentacarbonil de ferro, tetraclorur de titani, cisplatí
Compostos organometàl·lics
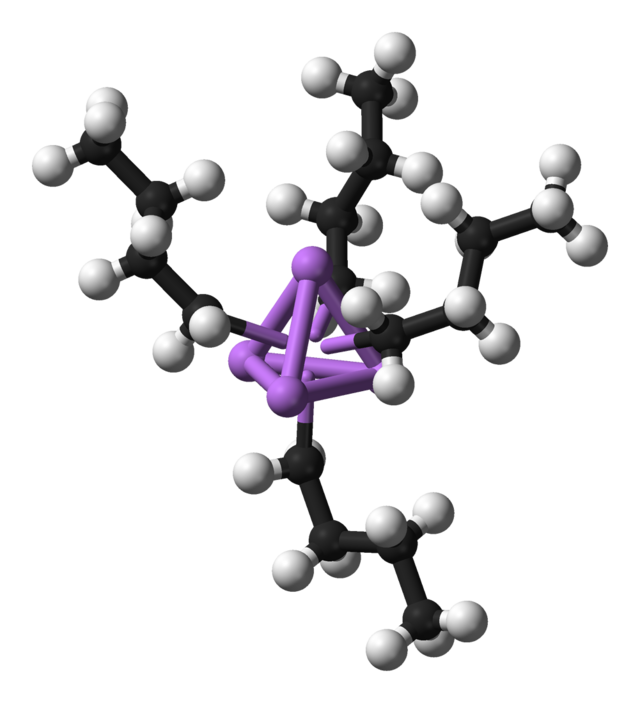
Normalment es considera que els compostos organometàl·lics contenen el grup M-C-H.[4] El metall (M) en aquestes espècies pot ser bé un element dels grups principals bé un metall de transició. Operacionalment, la definició d'un compost organometàl·lic és més relaxada de manera que també inclou complexos altament lipofílics com el carbonil metàl·lic i, fins i tot, alcòxids metàl·lics.
Els compostos organometàl·lics són considerats una categoria especial perquè els lligands orgànics solen ser sensibles a la hidròlisi o l'oxidació, fent necessari que la química organometàl·lica faci servir mètodes preparatius més especialitzats que els tradicionals en els complexos de tipus Werner. La metodologia sintètica, especialment la capacitat per manipular complexos en solvents de baix poder de coordinació, permeteren l'exploració de lligands de coordinació molt febles com hidrocarbons, H₂, i N₂.
Compostos d'agregats

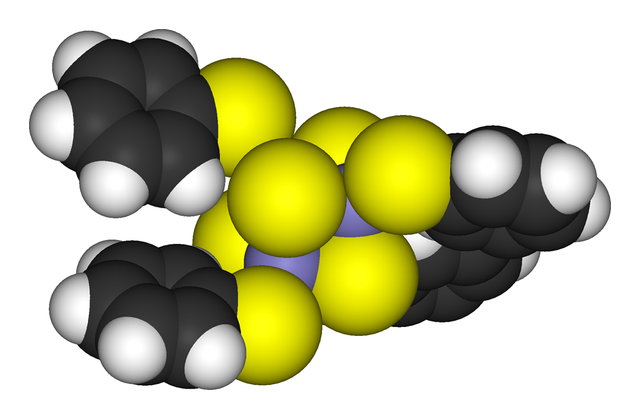
Els agregats es poden trobar en totes les classes de compostos químics. D'acord amb la definició més acceptada, un agregat consisteix en la seva mínima forma en un conjunt d'àtoms triangular els quals estan directament enllaçats uns amb els altres. Els complexos dimetàl·lics d'enllaç metall-metall són altament rellevants dins d'aquesta àrea. Els agregats tenen lloc en sistemes inorgànics "purs", en química organometàl·lica, en química dels grups principals i en química bioinorgànica. La distinció entre agregats molt i molt grans i sòlid és una línia molt difuminada. És la base química de la nanociència o nanotecnologia.
Compostos bioinorgànics
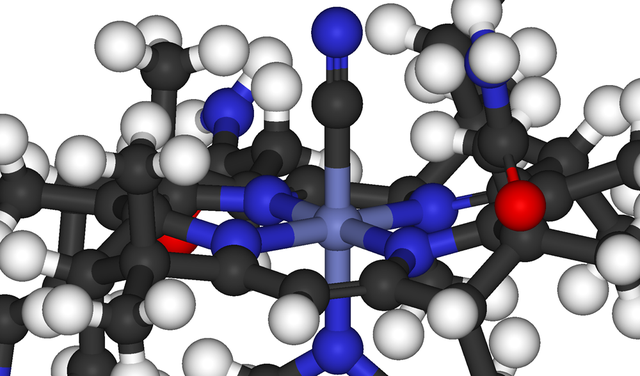
Per definició, els compostos bioinorgànics ocorren en la natura, perà el subcamp també inclou espècies antropogèniques com contaminants (per exemple metilmercuri) i drogues (per exemple cisplatí).[5] El camp, que incorpora molts aspectes de la bioquímica, inclou molts tipus de compostos com, per exemple, els fosfats a l'ADN, i també complexos metàl·lics que contenen lligands que van des de les macromolècules biològiques –pèptids– fins espècies com l'àcid húmic i l'aigua. Tradicionalment, la química bioinorgànica se centra en la transferència d'electrons (i energia) en proteïnes. La química inorgànica medicinal proposa l'estudi tant d'elements essencials com no essencials amb aplicacions en diagnosis i teràpies.
- Exemples: hemoglobina, metilmercuri, carboxipeptidasa
Compostos d'estat sòlid

Aquest camp important se centre en l'estructura química,[6] els enllaços i les propietats físiques dels materials. En la pràctica, la química inorgànica de l'estat sòlid fa servir tècnica com la cristal·lografia per poder entendre les propietats que resultes de les interaccions col·lectives entre les subunitats del sòlid. En la química de l'estat sòlid s'estudien els metalls i els seus aliatges o derivats intermetàl·lics. Els camps relacionats són la física de la matèria condensada, la mineralogia i la ciència de materials.
- Exemples: xips de silici, zeolita, YBa₂Cu₃O₇
Una perspectiva alternativa en l'àrea de química inorgànica comença amb el model atòmic de Bohr de l'àtom i, utilitzant les eines i models de química teòrica i química computacional, s'expandeix fins a enllaçar amb molècules simples i després més complexes. Les descripcions precises de mecànica quàntica per espècies de molts electrons és difícil: aquest repte ha proporcionat diverses aproximacions semiquantitatives o semiempíriques que inclouen la teoria molecular orbital i la teoria del camp dels lligands. Paral·lelament a aquestes descripcions teòriques es fan servir metodologies aproximatives, entre elles la teoria del funcional de la densitat.
Les excepcions a aquestes teories –tant qualitatives com quantitatives– són extremadament importants en el desenvolupament d'aquest camp. Per exemple, el CuII₂(OAc)₄(H₂O)₂ és gairebé diamagnètic sota la temperatura ambient mentre que la teoria del camp cristal·lí prediu que la molècula tindria dos electrons desaparellats. El desacord entre la teoria qualitativa (paramagnètic) i l'observació (diamagnètic) conduí al desenvolupament de models per l'"aparellament magnètic", els quals al mateix temps van donar lloc a nous materials i noves tecnologies.
Teories qualitatives

La química inorgànica s'ha beneficiat en gran manera de les teories qualitatives. Aquestes teories són més senzilles d'aprendre perquè requereixen pocs coneixements previs de teoria quàntica. Entre els compostos de grups principals, la teoria de repulsió de parells d'electrons de la capa de valència prediu (o racionalitza) l'estructura dels compostos dels grups principals; per exemple, explica per què l'NH₃ és piramidal mentre que el ClF₃ té forma de T. Pels metalls de transició, la teoria del camp cristal·lí permet comprendre el magnetisme de molts complexos simples, com ara per què el [FeIII(CN)₆]3− té un sol electró desaparellat, mentre que el [FeIII(H₂O)₆]3+ en té cinc.
Teoria de grups simètrics moleculars
Un tema central de la química inorgànica és la teoria de la simetria molecular.[7] La teoria de grups matemàtica proveeix la química inorgànica del llenguatge per a descriure les formes de les molècules segons la seva simetria de grup de punts. La teoria de grups també permet la factorització i simplificació dels càlculs teòrics.
Les característiques espectroscòpiques són analitzades i descrites respecte a les propietats simètriques dels estats vibratoris o electrònics. El coneixement de les propietats simètriques de l'estat normal i excitat permet predir els nombres i intensitats de les absorcions en l'espectre vibratori i electrònic. Una aplicació clàssica de la teoria de grups és la predicció del nombre de vibracions de C-O en complexes carbonil de metall substituït. Les aplicacions més comunes de simetria en l'espectroscòpia inclou l'espectre vibratori i electrònic.
Com a eina instructora, la teoria de grup remarca similituds i diferències en els enllaços d'espècies que semblen molt llunyanes entre si, com el WF₆ i el Mo(CO)₆ o el CO₂ i el NO₂.
Una aproximació quantitativa alternativa a la química inorgànica se centra en les energies de les reaccions. Aquesta aproximació és molt tradicional i empírica, però també molt útil. Alguns conceptes que es basen en la termodinàmica inclouen el potencial redox, l'acidesa i els canvis de fase. Un concepte clàssic de la termodinàmica inorgànica és el cicle de Born-Haber, que és utilitzat per determinar les energies de processos elementals com l'afinitat electrònica, alguns dels quals no es poden observar directament.
Un aspecte important i cada cop més popular se centre en les vies de reacció. Els mecanismes de reacció es discuteixen de manera diferent per cada classe diferent de compost química.
Elements dels grups principals i lantanoides
Els mecanismes dels compostos de grups principals (grups 13-18) se solen discutir dins el context de la química orgànica (de fet, els compostos orgànics són compostos dels grups principals). Els elements més pesants que el C, N, O i F solen formar compostos amb més electrons que els que es poden predir amb la regla de l'octet (vegeu l'article sobre hipervalència). Els mecanismes de les seves reaccions difereixen dels compostos orgànics per aquesta raó. D'altra banda, els elements més lleugers que el carboni (B, Be i Li), així com l'Al i el Mg solen formar estructures deficients d'electrons que són electrònicament similars als carbocations. Aquest tipus d'espècies tendeixen a reaccionar en vies associatives. La química dels lantanoides, finalment, coincideix en molts aspectes amb la química de l'alumini.
Complexos de metalls de transició
Els mecanismes per a les reaccions dels metalls de transició es discuteixen de manera diferent dels compostos dels grups principals.[8] El rol important dels orbitals d en els enllaços influencia fortament les vies i velocitats de la substitució i dissociació de lligands (vegeu els articles sobre química de coordinació i lligands).
Un altre aspecte de la química mecanística dels metalls de transició és la labilitat cinètica del complex, il·lustrada per l'intercanvi d'aigua lliure i no lliure en els complexos prototípics [M(H₂O)₆]n+:
- [M(H₂O)₆]n+ + 6 H₂O* → [M(H₂O*)₆]n+ + 6 H₂O
- on H₂O* denota aigua enriquida isotòpicament, per exemple H₂17O
La velocitat d'intercanvi d'aigua varia en 20 ordres de magnitud al llarg de la taula periòdica: els complexos lantànids són els més veloços i les espècies d'Ir (III) són les més lentes.
Reaccions redox
Les reaccions redox són freqüents pels elements de transició. Es consideren dues classes de reaccions redox: les reaccions de transferència d'àtoms (eliminació oxidant additiva/reductiva) i la transferència d'electrons. Una reacció redox fonamental és la d'"auto-intercanvi", que inclou la reacció degenerativa entre un oxidant i un reductor. Per exemple, el permanganat i el seu relatiu reduït d'un electró manganat de potassi intercanvien un electró:
- [MnO₄]− + [Mn*O₄]2− → [MnO₄]2− + [Mn*O₄]−
Reaccions als lligands
Els lligands coordinats mostres una reactivitat diferent dels lligands lliures. Per exemple, l'acidesa dels lligands de l'amoníac en [Co(NH₃)₆]3+ és elevat respecte al mateix NH₃. Els alquens lligats a cations metàl·lics són reactius davant nucleòfils, encara que normalment els alquens no són pas reactius. La gran i industrialment important àrea de la catàlisi es basa en l'habilitat dels metalls per modificar la reactivitat dels lligands orgànics. La catàlisi homogènia té lloc en solucions, i la catàlisi heterogènia té lloc quan substrats gasosos o dissolts interaccionen amb superfícies o sòlids. Tradicionalment, la catàlisi homogènia és considerada part de la química organometàl·lics i la catàlisi heterogènia es discuteix en el context de química de superfícies, un subcamp de la química de l'estat sòlid. Al capdavall, però, els principis bàsics químics inorgànics són els mateixos. Els metalls de transició, de manera gairebé única, reaccionen amb petites molècules com CO, H₂, O₂ i C₂H₄.
A causa del rang divers dels elements i la corresponent diversitat de propietats dels derivats resultants, la química inorgànica està molt associada amb molts mètodes d'anàlisi. Els mètodes antics tendien a examinar propietats "sòlides" com ara la conductivitat elèctrica de les solucions, els punts de fusió, la solubilitat i l'acidesa. Després de l'aparició de la teoria quàntica i de la corresponent expansió dels aparells electrònics, s'han introduït noves eines que ajuden a comprovar les propietats electròniques de molècules i sòlids inorgànics. Sovint, aquestes mesures proveeixen punts de vista molt rellevants pels models teòrics. Per exemple, les mesures de l'espectre fotoelectrònic del metà van demostrar que descriure com s'enllacen el carboni i l'hidrogen (dos centres i dos enllaços) usant la teoria d'enllaç de valència no és apropiat per descriure els processos de ionització de manera senzilla. Aquestes precisions van conduir a una popularització de la teoria orbital molecular, ja que els orbitals completament localitzats són una descripció simple i més apropiada per a l'eliminació i l'excitació d'electrons.
Algunes tècniques que es fan servir sovint són les següents:
- Cristal·lografia de raigs X: aquesta tècnica permet fer la determinació en tres dimensions d'estructures moleculars.
- Interferòmetre de polarització dual: aquesta tècnica mesura la conformació i el canvi conformacional de les molècules.
- Diverses formes d'espectroscòpia:
- Espectroscòpia ultraviolada-visible: històricament aquesta fou una eina important, ja que molts compostos inorgànics tenen forts colors.
- Espectroscòpia NMR: a part de l'¹H i el 13C, molts altres "bons" nuclis NMR (per exemple el 11B, el 19F, el 31P i el 195Pt) proveeixen una important informació sobre les propietats i estructura dels compostos. A més, l'NMR d'espècies paramagnètiques pot resultar en una important informació estructural. L'NMR protònic també és important perquè el lleuger nucli d'hidrogen no es pot detectar fàcilment amb una cristal·lografia de raigs X.
- Espectroscòpia infraroja: es fa servir per absorcions de lligands carbonil.
- Ressonància electrònica nuclear doble (ENDOR)
- Espectroscòpia de Mössbauer
- Ressonànica paramagnètica electrònica o ressonància d'espín electrònic (RPE o REE) permet la mesura de l'ambient de centres metàl·lics paramagnètics.
- Electroquímica: la voltamperometria cíclica i les seves tècniques relacionades investigues les característiques redox de compostos.
Tot i que algunes espècies inorgàniques es poden obtenir en la seva forma pura de la natura, la majoria són sintetitzades en plantes químiques i al laboratori.
Els mètodes de sintetització inorgànica es poden classificar segons la volatilitat o solubilitat dels reactius components.[9] Els compostos inorgànics solubles són preparats fent servir mètodes de síntesi orgànica. Pels compostos que contenen metalls i que són reactius davant l'aire se segueixen les tècniques de la línia de Schlenk i de la caixa de guants. Els compostos volàtils i gasos es manipulen en col·lectors de buit que consisteixen en conduccions de vidre interconnectades amb vàlvules que, en conjunt, es poden buidar a 0,001 mmHg o fins i tot menys. Els compostos es condensen fent servir nitrogen líquid (per sota dels 78 K) o altres criogens. Els sòlids se solen preparar fent servir forns de tub, i els reactius i productes se solen tancar en contenidors fets de sílex fos (SiO₂ amorf), tot i que de vegades es tracta de materials més específics com tubs soldats de tàntal o "vaixells" de platí. els productes i reactius es transporten entre zones de diferent temperatura per conduir reaccions.
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.