From Wikipedia, the free encyclopedia
Luminol (C8H7N3O2) je hemijski spoj koji pokazuje luminiscenciju, sa plavim sjajem, kada se pomeša sa odgovarajućim oksidacijskim agensom. Luminol je bijela do blijedo-žuta kristalna čvrsta supstanca koja je rastvorljiva u većini polarnih organskih rastvarača, ali nerastvorljiva u vodi.
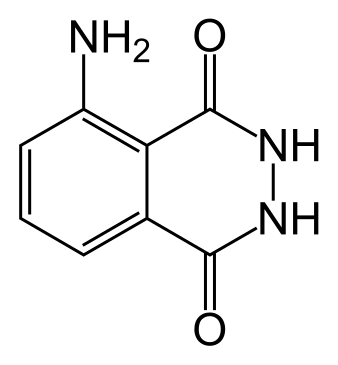
Luminol[1]
  | |
|---|---|
| Općenito | |
| Hemijski spoj | Luminol[2]
  |
| Druga imena | = Amino-2,3-dihidroftalazin-1,4-dion, 5-Amino-2,3-dihidro-1,4-ftalazinedion o-Aminoftaloil hidrazid o-Aminoftalil hidrazid 3-Aminoftalhidrazid 3-Aminoftalni hidrazid |
| CAS registarski broj | 521-31-3 |
| SMILES | c1cc2c(c(c1)N)c(=O)[nH] [nH]c2=O |
| InChI | 1/C8H7N3O2/c9-5-3-1-2-4-6(5)8(13)11-10-7(4)12/h1-3H,9H2,(H,10,12)(H,11,13) |
| Osobine1 | |
| Molarna masa | 177,16 g/mol |
| Tačka topljenja | 319 PubChem: 10638 |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Forenzički istražitelji koriste luminol da otkriju količine krvi u tragovima na mjestu zločina, jer reaguje sa gvožđem u hemoglobinu. Biolozi ga koriste u ćelijskim testovima za otkrivanje bakra, gvožđa, cijanida, kao i specifičnih proteina putem Western blottiranja.[3]
Kada se luminol ravnomjerno rasprši po površini, tragovi aktivirajućeg oksidansa čine da luminol emituje plavi sjaj koji se može vidjeti u zamračenoj prostoriji. Sjaj traje samo oko 30 sekundi, ali se može fotografski dokumentovati. Sjaj je jači u područjima koja primaju više spreja; intenzitet sjaja ne ukazuje na količinu krvi ili drugog prisutnog aktivatora.
Luminol se sintetiše u procesu od dva koraka, počevši od 3-nitroftalne kiseline.[4][5] Prvo, hidrazin (N2H4) se zagrijava sa 3-nitroftalnom kiselinom u rastvaraču visokog ključanja kao što su trietilen-glikol i glicerol. Dolazi do acilne supstitucijske reakcija kondenzacije, uz gubitak vode, formirajući 3-nitroftalhidrazid. Redukcija nitro grupe u amino grupu sa natrij-ditionitom (Na2S2O4), preko prolaznog hidroksilaminskog intermedijara, proizvodi luminol.

Spoj je prvi put sintetiziran u Njemačkoj 1902,[6] ali nije imenovan kao luminol sve do 1934.[4][7]

Da bi pokazao svoju luminescenciju, luminol mora biti aktiviran oksidansom. Obično je aktivator rastvor koji sadrži vodik-peroksid (H2O2) i hidroksidne ione u vodi. U prisustvu katalizatora kao što su gvožđevi ili periodatni spojevi, vodik-peroksid se razlaže da bi formirao kiseonik i vodu:
Laboratorijske postavke često koriste kalij-fericijanid ili kalij-perjodat kao katalizator. U forenzičkoj detekciji krvi, katalizator je gvožđe prisutno u hemoglobinu.[8] Enzimi u različitim biološkim sistemima također mogu katalizirati razgradnju vodik-peroksida.
Tačan mehanizam hemiluminiscencije luminola je složena reakcija u više koraka, posebno u vodenim uslovima. Nedavno teorijsko istraživanje moglo je razjasniti kaskadu reakcija kao što je prikazano u nastavku.[9] Luminol se prvo deprotonira u baznim uvjetima, a zatim oksidira u anionski radikal. On zauzvrat ima dva dostupna puta za davanje ključnog intermedijara α-hidroksi-peroksida. Nakon ciklizacije do endoperoksida, mono-anion će se podvrgnuti razgradnji bez luminescencije, ako je pH prenizak (< 8,2) za drugu deprotonaciju. Endoperoksidni dianion, međutim, može dati retro-Diels-Alderov proizvod: 1,2-dioksan-3,6-dion dianion. I nakon hemijske ekscitacije pomoću dva jednostruka prijenosa elektrona (SET) daje 3-aminoftalatni dianjon u svom prvom singletnom pobuđenom stanju (S1). Ova vrlo nestabilna molekula se relaksira do osnovnog stanja, čime emituje svjetlost talasne dužine od oko 425 nm (ljubičasto-plava), takozvanu hemiluminiscenciju.

Godine 1928., njemački hemičar H. O. Albrecht otkrio je da krv, između ostalih tvari, pojačava luminescenciju luminola u alkalnom rastvoru vodik-peroksida.[10][11] U 1936., Karl Gleu i Karl Pfannstiel potvrdili su ovo poboljšanje u prisustvu hematina, komponente krvi.[12] Zatim je, 1937., njemački forenzičar Walter Specht napravio je opsežne studije o primjeni luminola u otkrivanju krvi na mjestima zločina..[13] Godine 1939. patolozi iz San Francisca, Frederick Proescher i A. M. Moody napravili su tri važna zapažanja o luminolu:[14][15]
Istražitelji mjesta zločina koriste luminol da pronađu tragove krvi, čak i ako ga je neko očistio ili uklonio. Istraživač prska tragove rastvorom luminola i oksidansa. Gvožđe u krvi katalizuje luminescenciju. Količina katalizatora neophodna za izazivanje reakcije je vrlo mala u odnosu na količinu luminola, što omogućava detekciju čak i tragova krvi. Plavi sjaj traje oko 30 sekundi po aplikaciji. Za otkrivanje sjaja potrebna je prilično mračna prostorija. Svaki otkriveni sjaj može biti dokumentovan dugom ekspozicijom fotografija.
Upotreba luminola u istrazi mjesta zločina donekle je otežana činjenicom da reaguje na spojeve koji sadrže gvožđe i bakar,[16] Primjena luminola na dokazni trag može spriječiti izvođenje drugih testova na njemu; međutim DNK je uspješno ekstrahirana iz uzoraka izloženih luminolu.[17]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.