From Wikipedia, the free encyclopedia
Cikloalkani su zasićeni ciklični ugljovodonici u kojima su svi ugljikovi atomi vezani jednostrukim vezama. Opća formula ovih jedinjenja je CnH2n, jer cikloalkani imaju dva atoma vodika manje od alkana (zato što formiraju prsten).



Veličina cikloalkanskog prstena može biti veoma različita. Veličina prstenova ovisi o broji ugljikovih atoma. Dosad su poznata jedinjenja čak sa preko 40 ugljikovih atoma.[1][2][3][4][5]
Opća formula cikloalkana u homolognom nizu je CnH2n. Nazivi cikloalkana se izvode prema imenu alkana sa istim brojem atoma ugljika uz prefiks ciklo–.
| Redni broj | Ime | Molekulska formula | Strukturna formula |
| 1. | Ciklopropan | C3H6 |  |
| 2. | Ciklobutan | C4H8 |  |
| 3. | Ciklopentan | C5H10 |  |
| 4. | Cikloheksan | C6H12 | 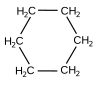 |
Cikloalkani dobijaju imena tako da se ispred imena alkana sa istim brojem ugljikovih atoma doda prefiks –ciklo. Pojednostavljeno se mogu prekazivati pomoću geometrijskih slika. Tako da se ciklopropan predstavlja istostraničnim trokutom, ciklobutan – kvadratom, ciklopeentan petouglom, itd. Obično se prikazuje samo skelet rasporeda ugljikovih atoma, a podrazumijeva se da na svakom uglu imaju po dva vezanavodikova atoma.
CH2 H2C-CH2 H2C-CH2
/ \ | | / \
H2C-CH2 H2C-CH2 H2C CH2
\ /
CH2
| Ciklopropan | Ciklobutan | Ciklopentan |
|---|
Glavni izvori ciklopentana, cikloheksana, metilciklopentana i metilcikloheksana je nafta pa su zbog toga u industriji nafte poznati kao nafteni. U prirodi su inače najrasprostranjenija jedinjenja sa petočlanim i šestočlanim prstenovima.
Cikloalkani se laboratorijski dobijaju putem eliminacije halogena iz dihalogenoalkana
CH2-CH2
Cl-CH2-CH2-CH2-Cl + Zn → \ /
CH2
Fizička svojstve cikloalkana su veoma slična poredivim kod alkana. Sa povećanjem broja ugljikovih atoma, raste im temperatura ključanja.
| Naziv | Temperatura ključanja | Temperatura topljenja |
| Ciklopropan | 33 °C | -127 °C |
| Ciklobutan | 13 °C | - 90 °C |
| Ciklopentan | 49 °C | -94 °C |
| Cikloheksan | 81 °C | 7 °C |
Cikloalkani ispoljavaju identične hemijske osobine kao i alkani, izuzev što su cikloalkani sa malim prstenom (ciklopropan, ciklobutan) dosta reaktivniji od ostalih.
Tako, naprimjer, ciklopropan reagira sa vodikom u prisustvu katalizatora (Nikla (Ni), kada nastasje propan.
Na isti način reagir sa bromom i bromovodikom
→ CH2CH2CH2 | | Br Br
Opći oblik adicijskih reakcija je:
R-CH=CH-R' + CH2N2 → R-CH---CH-R
\ /
CH2
Ciklobutan je stabilniji od ciklopropana ali je također i dosta reaktivan i podložan adicijskim reakcijama.
Ciklopentan i cikloheksan su veoma postojani, tako da ne reaguju sa vodikom, čak ni na visokim temperaturama (preko 200 °C).
Cis-trans izomerija je moguća kod poremećeno supstituiranih cikloalkana, jer je zbog zatvaranja prstena stvorana dosta kruta struktura od dvije S-N veze. Tako dimetilciklopropan postoji u dva prostorna izomera: cis i trans.
Ovaj tip izomerije se javlja i kod alkena, pri čemu svi supstituenti nalaze u ravni, alo različito orijentirani u odnosu na dvostruku vezu, a kod cikloalkana supstituenti se nalaze ispod i iznad ravni.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.